
| 选项 | 说法 | 解释 |
| A | 加热条件下,浓硝酸与碳粉的反应可在铁制容器中进行 | 铁能被浓硝酸钝化 |
| B | 浓氨水可用于检验氯气管道泄露 | 过量的NH3与Cl2反应有白烟产生 |
| C | 用惰性电极电解MgCl2溶液可冶炼Mg | Mg2+在阴极得电子生成Mg |
| D | 葡萄糖和油脂均为人体所需能量的重要来源 | 二者在体内水解的产物被氧化可提供能量 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.铁与浓硝酸在常温下钝化,在加热条件下反应;
B.氨气与氯气反应生成氯化氢和氮气,氯化氢与氨气反应生成白色氯化铵固体;
C.电解氯化镁溶液生成氢气、氯气和氢氧化镁;
D.葡萄糖为单糖不能水解.
解答 解:A.加热条件下,浓硝酸与铁会发生反应,所以浓硝酸与碳粉的反应不能铁制容器中进行,故A错误;
B.氨气与氯气反应生成氯化氢和氮气,氯化氢与氨气反应生成白色氯化铵固体,产生大量白烟,浓氨水可用于检验氯气管道泄露,故B 正确;
C.电解氯化镁溶液生成氢气、氯气和氢氧化镁,得不到氯化镁,通常用电解熔融氯化镁制取镁,故C错误;
D.葡萄糖为单糖不能水解,故D错误;
故选:B.
点评 本题考查了元素化合物知识,熟悉浓硝酸强的氧化性、氯气、氨气的性质,明确电解池工作原理是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
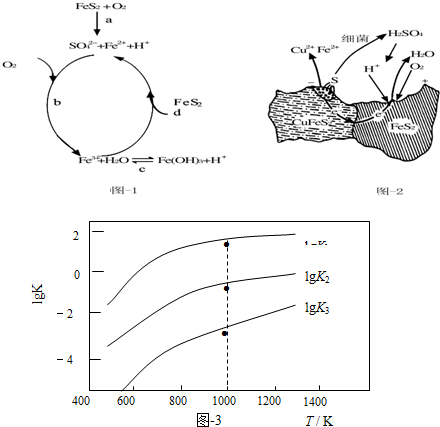
| 相关反应 | 反应热 | 平衡常数K |
| FeS2(s)+H2(g)?FeS(s)+H2S(g) | △H1 | K1 |
| $\frac{1}{2}$FeS2(s)+H2(g)?$\frac{1}{2}$Fe(s)+H2S(g) | △H2 | K2 |
| FeS(s)+H2(g)?Fe(s)+H2S(g) | △H3 | K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.
;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.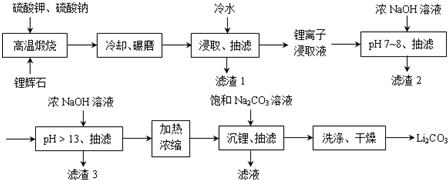
| 金属离子 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 |
| 沉淀完全的pH | 4.7 | 9.0 | 3.2 | 10.1 |
| 温度 溶解度 | 10℃ | 20℃ | 50℃ | 80℃ |
| Li2SO4 | 35.4 | 34.7 | 33.1 | 31.7 |
| Li2CO3 | 1.43 | 1.33 | 1.08 | 0.85 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
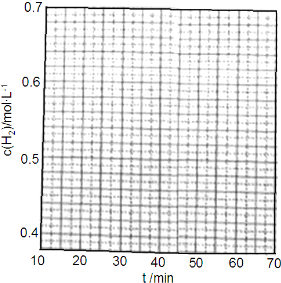
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
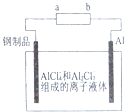 已知:银锌电池放电时总反应为Zn+Ag2O+H2O═Zn(OH)2+2Ag,用银锌电池作电源,在非水体系中完成钢制品上镀铝的原理如图所示,下列说法正确的是( )
已知:银锌电池放电时总反应为Zn+Ag2O+H2O═Zn(OH)2+2Ag,用银锌电池作电源,在非水体系中完成钢制品上镀铝的原理如图所示,下列说法正确的是( )| A. | a电极的电极反应式为Ag2O+H2O+2e-=2Ag+2OH- | |
| B. | 银锌电池的电解质溶液可用稀硫酸 | |
| C. | 银锌电池放电时,负极附近溶液的pH增大 | |
| D. | Al电极上发生的电极反应式为Al+7AlCl4--3e-=4Al2Cl4- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCHO和CH3COOH | B. | HCOOCH3和CH3COOH | ||
| C. | HCOOH和CH3COOH | D. | CH3CH2OH和CH3OCH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com