
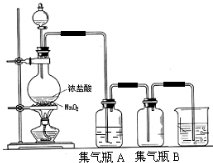
 实验室中所用少量氯气是用下列方法制取的,4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O
实验室中所用少量氯气是用下列方法制取的,4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O分析 (1)氯气能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,可以用氢氧化钠吸收氯气;
(2)依据C=$\frac{1000ω}{M}$计算质量分数为36.5%,密度为1.19g•cm-3的物质的量浓度,依据盐酸浓度变化计算消耗的盐酸的物质的量,依据方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O计算生成的氯气的物质的量,然后依据V=nVm计算氯气的体积.
解答 解:(1)氯气能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,离子方程式:Cl2+2OH-=Cl-+ClO-+H2O;
故答案为:氢氧化钠;Cl2+2OH-=Cl-+ClO-+H2O;
(2)质量分数为36.5%,密度为1.19g•cm-3的盐酸物质的量浓度C=$\frac{1000×1.19×36.5%}{36.5}$=11.9mol/L;
浓盐酸100mL,含有氯化氢的物质的量=11.9mol/L×0.1L=1.19mol;
反应后剩余氯化氢的物质的量:1.9mol/L×0.1L=0.19mol,
所以消耗的氯化氢的物质的量为:1.19-0.19=1mol,
依据方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
4 22.4L
1 V
解得V=5.6L;
故答案为:5.6.
点评 本题考查了氯气的制备,有关方程式的计算,熟悉制备原理是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 实验室用大理石和稀盐酸制取CO2:2H++CO32-=CO2↑+H2O | |
| B. | 铁和稀盐酸反应:2Fe+6H+=3H2↑+2Fe3+ | |
| C. | 在氢氧化钡溶液中加入少量小苏打:Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+2H2O | |
| D. | 碳酸氢钙溶液和稀盐酸反应:HCO3-+H+=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某科研小组研究在其他条件不变的情况下,改变起始氢气的物质的量[用n(H2)表示]对N2(g)+3H2(g)?2NH3(g)反应的影响,实验结果可表示成如图所示的规律(图中T表示温度,n表示物质的量):
某科研小组研究在其他条件不变的情况下,改变起始氢气的物质的量[用n(H2)表示]对N2(g)+3H2(g)?2NH3(g)反应的影响,实验结果可表示成如图所示的规律(图中T表示温度,n表示物质的量):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌跟稀硫酸反应:Zn+2H+=Zn2++H2↑ | |
| B. | 用氯化铁溶液腐蚀铜箔制造印刷电路板:Fe3++Cu=Fe2++Cu2+ | |
| C. | 碳酸钙中加入稀盐酸:CaCO3+2H+=Ca2++CO2↑+H2O | |
| D. | 单质氯气与水的反应:Cl2+H2O=H++Cl-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气通入醋酸溶液 CH3COOH+NH3═CH3COONH4 | |
| B. | 澄清的石灰水与盐酸反应:H++OH-═H2O | |
| C. | 碳酸钡加入稀硫酸:BaCO3+2H+═Ba2++H2O+CO2↑ | |
| D. | 氯气通入水中:Cl2+H2O═2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制0.1 mol•L-1的Na2SO3溶液490mL,需用500ml容量瓶 | |
| B. | 向2等份不饱和的烧碱溶液中分别加入一定量的Na2O2和Na2O,使溶液均恰好饱和,则加入的Na2O2与Na2O的物质的量之比等于1:1(保持温度不变) | |
| C. | 在标准状况下,将22.4L氨气溶于1L水中,得到1mol•L-1的氨水 | |
| D. | 10mL质量分数为70%的乙醇用10mL水稀释后;乙醇的质量分数小于35% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ | |
| B. | 90℃时,测得纯水中c(H+)•c(OH-)=3.8×10-13:H2O(l)?H+(aq)+OH-(aq)△H<0 | |
| C. | 氨水中滴入酚酞溶液,溶液变红:NH3•H2O=NH4++OH- | |
| D. | 向苯酚钠溶液中通入CO2,溶液变浑浊:2C6H5ONa+CO2+H2O→2C6H5OH+Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com