
| A. | 只有①③ | B. | 只有①② | C. | 只有②③ | D. | ①②③ |
分析 ①②为放热反应,物质发生化学反应时,生成液态水比生成气态水放出的热量多,反应越完全,放出的热量越多,
③中前者为吸热反应,后者为放热反应,吸热反应△H>0,放热反应△H<0,以此解答该题.
解答 解:①都为放热反应,△H<0,由于S(s)→S(g)吸热,则前者放出的热量少,则△H1>△H2,故正确;
②都为放热反应,△H<0,消耗的氢气越多,则放出的热量越多,则△H3>△H3,故正确;
③前者为吸热反应,△H5>0,后者为放热反应,△H6<0,则△H5>△H6,故正确.
故选D.
点评 本题考查反应热的大小比较,题目难度中等,本题注意从物质反应的程度以及物质的聚集状态的角度比较反应热的大小,本题中含有能正确判断反应的吸放热.


科目:高中化学 来源: 题型:选择题
| A. | 遇苯酚变紫色的溶液:Na+、Mg2+、SO42-、Cl- | |
| B. | 使甲基橙变红色的溶液:NH4+、Cu2+、ClO-、Cl- | |
| C. | 0.1mol/LNaHCO3溶液:K+、AlO2-、Cl-、NO3- | |
| D. | 0.1mol/L(NH4)2Fe(SO4)2溶液中:K+、Cu2+、Cl-、MnO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH+4 Na+ NO-3 Cl- | B. | Fe2+ K+ HS- ClO- | ||
| C. | Ca2+ K+ SO32- CH3COO- | D. | K+ Na+ Cl- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3是发酵粉的主要成分之一 | B. | MgO常用作耐高温材料 | ||
| C. | 石灰石可用作工业炼铁的原料 | D. | 工业上可用Cl2制造漂白粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
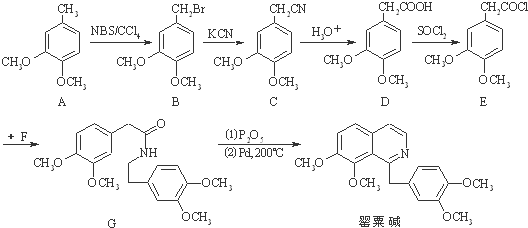
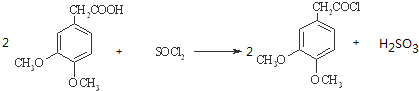 .
.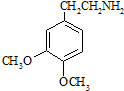 .
.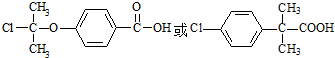 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+ H+ SO42- | B. | Ba2+ NO3- CO32- | ||
| C. | Al3+ H+ CO32- | D. | OH- Cu2+ NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com