
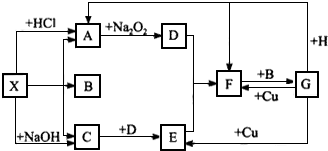
分析 常温下X是固体,X既能与酸反应生成气体A,又能与碱反应生成气体C,故X应为弱酸的铵盐,则气体C为NH3,气体A能与Na2O2反应得到气体D,则A为CO2,D为O2,氨气与氧气反应生成气体E为NO,NO与氧气反应生成气体F为NO2,1molX分解得到A、B、C各1mol,且B为液体,则X是NH4HCO3,B为H2O.液体G与Cu反应可以得到NO、NO2,而NO2与水反应得到G,故G为HNO3,则固体H为碳.
解答 解:常温下X是固体,X既能与酸反应生成气体A,又能与碱反应生成气体C,故X应为弱酸的铵盐,则气体C为NH3,气体A能与Na2O2反应得到气体D,则A为CO2,D为O2,氨气与氧气反应生成气体E为NO,NO与氧气反应生成气体F为NO2,1molX分解得到A、B、C各1mol,且B为液体,则X是NH4HCO3,B为H2O.液体G与Cu反应可以得到NO、NO2,而NO2与水反应得到G,故G为HNO3,则固体H为碳.
(1)由上述分析可知,X为NH4HCO3,检验氨气的方法是:使湿润的红色石蕊试纸变蓝,
故答案为:NH4HCO3;使湿润的红色石蕊试纸变蓝;
(2)①H+G→A+F的化学方程式:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
②C+D→E的化学方程式:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(3)反应G+Cu→E的离子方程式:3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O,
故答案为:3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O.
点评 本题考查无机物的推断,最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等,侧重于学生的分析能力和推断能力的考查,注重于元素化合物知识的综合运用.


科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ③④②① | C. | ①②③④ | D. | ③④①② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴化钙的化学式:CaBr | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 氟离子的结构示意图: | D. | 四氯化碳的电子式: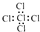 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铵盐化学性质都很稳定 | |
| B. | 锌片与稀硝酸反应可制得氢气 | |
| C. | 雷雨天气时空气中能生成少量的氮氧化物 | |
| D. | O2、NO、NO2都能用浓硫酸干燥,且通常情况下能共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I-、H+、Cl-、NO3- | B. | Al3+、K+、OH-、Ba2+ | ||
| C. | Mg2+、Fe3+、Cl-、NO3- | D. | Ca2+、SO42-、NO3-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原NaBr溶液分层,上层液体呈现橙色 | |
| B. | 原NaBr溶液分层,下层液体呈现橙色 | |
| C. | 原KI溶液分层,上层几乎无色 | |
| D. | 原KI溶液分层,下层呈现紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数 | 1.8×10-5 | 4.9×10-10 | K1=9.1×10-8 K2=1.1×10-12 |
| A. | 等物质的量浓度的各溶液pH关系为:pH(Na2S)>pH(NaCN)>pH(NaHS)>pH(CH3COONa) | |
| B. | 用0.1mol/L的NaOH溶液滴定PH值相等的CH3COOH和HCN溶液,CH3COOH消耗的NaOH溶液体积更大 | |
| C. | NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)+c(H2S) | |
| D. | 某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=10-d mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com