
【题目】下列化合物分子中的所有原子都处于同一平面的是( )
A. 溴苯 B. 对二甲苯
C. 丙炔 D. 丙烯
科目:高中化学 来源: 题型:
【题目】生活和生产中常用到胶体的性质,请看下述四例:
(1)做实验时,手指不慎被玻璃划破,可从急救箱中取氯化铁溶液应急止血,其原理是 。
(2)在陶瓷工业上常遇到因陶土里混有氧化铁而影响产品质量。解决方法之一是把这些陶土和水一起搅拌,使微粒直径在10-9~10-7 m之间,然后插入两根电极,再接通直流电源。这时阳极聚集陶土胶粒,阴极聚集氧化铁胶粒,理由是 。
(3)实验室里制取氢氧化铁胶体利用了水解原理,用氯化铁制取氢氧化铁胶体的化学反应方程式为:____________,制备时将饱和的FeCl3溶液滴入沸水中,选用沸水的原因是:____________。
(4)四氧化三铁在强碱性溶液中与次氯酸盐反应,生成高铁酸盐(![]() ),
),![]() 有强氧化性,可以杀菌消毒。高铁酸盐还有净化水的作用,能净化水的原因是 。
有强氧化性,可以杀菌消毒。高铁酸盐还有净化水的作用,能净化水的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列未知盐的稀溶液所含离子的检验中,作出的判断一定正确的是( )
A. 当加入硝酸钡溶液时不产生沉淀,当再加入硝酸银溶液时,有不溶于稀硝酸的白色沉淀生成,可判定含有Cl-
B. 加入硝酸钡溶液有白色沉淀生成,再加稀盐酸酸化沉淀不消失,可判定含有![]()
C. 加入NaOH溶液,有白色沉淀产生,可判定含有Mg2+
D. 加入盐酸后有无色气体逸出,此气体能使澄清石灰水变浑浊,可判定含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要证明某溶液中不含有Fe3+而可能含有Fe2+,进行如下实验操作时最佳顺序为( )
①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量KSCN溶液
A. ①③ B. ②③
C. ③① D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、H2、CH3、OH均是清洁能源。
(1)已知部分化学键键能数据如下:
化学键 | C | O=O | C=O | C-O |
E/(kJ mol-1) | 958.5 | 497 | 745 | 351 |
2CO(g) +O2(g)==2CO2(g) △H1
H2O(g)+CO(g)==H2(g) + CO2(g) △H2 = -41 kJmol-1
CH3OH(g)+ 3/2O2(g)==CO2(g)+2H2O(g) △H3 = -660kJmol-1
则△H1=_____ kJmol-1,反应CO(g)+2H2(g) ![]() CH3OH(g)的△H=_____ kJmol-1。
CH3OH(g)的△H=_____ kJmol-1。
(2)一定条件下,在容积为2 L的密闭容器Q中充入a mol CO与b molH2合成甲醇:CO(g) +2H2(g) ![]() CH3OH(g)。测得平衡时混合气体中CH3OH的体积百分含量与温度、 压强之间的关系如图1所示,图2表示在一定温度下,H2的平衡转化率与反应开始时两种反应物的投料物质的量之比(用X表示)、压强之间的关系。
CH3OH(g)。测得平衡时混合气体中CH3OH的体积百分含量与温度、 压强之间的关系如图1所示,图2表示在一定温度下,H2的平衡转化率与反应开始时两种反应物的投料物质的量之比(用X表示)、压强之间的关系。
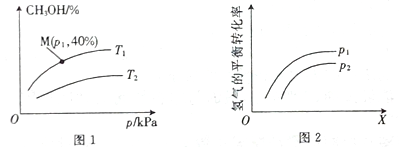
①压强相同时,温度为T1、T2时,反应达到平衡所需要的时间分别为t1、t2,则二者之间的相对大小为t1___ t2(填“>”、“<”、“=”或“无法确定”)。
②p1_____p2(填“>”、“<”、“=”或“无法确定”)。
③若a =2,b=4,则压强为p1、温度为T1时该反应的平衡常数K=______________。
④若在压强为P1、温度为T1时,向Q容器中同时加入等物质的量的CO、H2、CH3OH三种气体,则反应开始时,v(CH3OH)正_____v(CH3OH)逆(填“>”、“<”、“=”或“无法确定”)。
(3)甲醇燃料电池是一种具有高能量转化率的绿色电池,则用磷酸溶液作电解质时,负极的电极反应式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 氯化铁溶液与碘化钾溶液反应:Fe3++2I-===Fe2++I2
B. 硫酸溶液与氢氧化钡溶液反应:Ba2++SO![]() ===BaSO4↓
===BaSO4↓
C. 醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+===Ca2++H2O+CO2↑
D. 氯化铝溶液与过量氨水反应:Al3++3NH3·H2O===Al(OH)3↓+3NH![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)基态Fe2+离子有______个未成对电子,基态Ni原子的电子排布式为__________。
(2)用“>”或“<”填空:
第一电离能 | 熔点 | 酸性 |
Si_____S | NaCl______Si | H2SO4_____HClO4 |
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为_______。其中氧原子的杂化方式为_____。
(4)与H2O互为等电子体的一种阳离子为________(填化学式);
(5)Ni能与CO形成正四面体形的配合物Ni(CO)4,1mol Ni(CO)4中含有______molσ键。
(6)CaF2难溶于水,但可溶于含A13+的溶液中,原因是________(用离子方程式表示)。已知AlF63+溶液中可稳定存在。
(7)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,其晶胞边长为540.0 pm,密度为_______(列式并计算),a位置S2-离子与b位置Zn2+离子之问的距离为_____pm(列式表示)
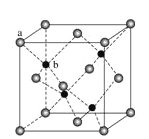
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
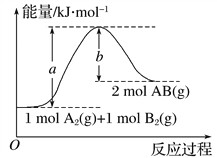
A. 断裂1 mol A—A和1 mol B—B键,放出a kJ能量
B. 每生成2 mol AB(g)吸收b kJ能量
C. 该反应中反应物的总能量高于生成物的总能量
D. 该反应热ΔH=(a-b) kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com