
【题目】在容积不变的密闭容器中,一定条件下发生反应:2AB(g)+2C(g),且达到平衡.当升高温度时气体的密度增大,则下列叙述中正确的是( )
A.升高温度,正反应速率增大,逆反应速率减小
B.若正反应是放热反应,则A为气态
C.若向容器中充入惰性气体,则平衡向右移动
D.物质A一定为非气态,且正反应是吸热反应
【答案】D
【解析】解:A、升高温度,正反应速率增大,逆反应速率增大,故A错误;
B、升高温度,容器内气体的密度增大,平衡正向移动,正反应是吸热反应,故B错误;
C、若向容器中充入惰性气体,各组分浓度不变,则平衡不移动,故C错误;
D、,升高温度,容器内气体的密度增大,说明气体的质量增大,要使气体的密度增大,根据ρ= ![]() 知,A一定为非气态,且正反应是吸热反应,故D正确;
知,A一定为非气态,且正反应是吸热反应,故D正确;
故选D.
【考点精析】利用化学平衡状态本质及特征对题目进行判断即可得到答案,需要熟知化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).


 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组对铜与浓硫酸反应产生的黑色沉淀(可能含有CuO、CuS、Cu2S,其中CuS和 Cu2S不溶于稀盐酸、稀硫酸)进行探究,实验步骤如下:
Ⅰ.将光亮铜丝插人浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为 .
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是 .
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
装置 | 现象 | 结论及解释 |
| ①A试管中黑色沉淀逐渐溶解 | a.现象②说明褐色沉淀具有 |
(4)CuS固体能溶于热的浓硫酸,请用有关平衡移动原理加以解释: .
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4﹣+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4﹣+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2 , 过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2 溶液反应完全.则混合物中Cu2S 的质量分数为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】市场上常有一些不法商贩为牟取暴利,用自来水冒充纯净水(蒸馏水)出售,为辨别真伪,请你选择以下试剂来鉴别,该试剂是
A.酚酞B.氯化钡C.硝酸银D.氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境监测测定水中溶解氧的方法是:
①量取amL水样,迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为:2Mn2++O2+4OH﹣=2MnO(OH)2(该反应极快).
②测定:打开瓶塞后迅速加入1~2mL浓硫酸(酸化),使之生成I2 , 再用b mol/L的Na2S2O3溶液滴定(以淀粉为指示剂),消耗V mL.有关反应式为MnO(OH)2+2I﹣+4H+=Mn2++I2+3H2O I2+4S2O32﹣=2I﹣+S2O32﹣
试回答:
(1)滴定过程中用到的玻璃仪器除了酸式滴定管、碱式滴定管外还缺少 ,
(2)滴定操作时,左手控制滴定管,右手 , 眼睛要注视
(3)滴定时(I﹣和S2O32﹣反应)以淀粉为指示剂,终点时溶液由色变为色.
(4)水中溶解氧的计算式为 . (以g/L为单位)
(5)测定时,滴定管经蒸馏水洗涤后立即加入滴定剂Na2S2O3标准溶液进行滴定,则会导致测定结果(填“偏高”“偏低”或“无影响”,下同).
(6)记录测定结果时,滴定前仰视刻度线,滴定到达终点时又俯视刻度线,将导致滴定结果 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铅蓄电池电解苦卤水 (含C1﹣、Br﹣、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中正确的是( ) 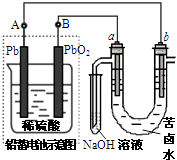
A.铅蓄电池负极的反应式为:Pb﹣2e ﹣→Pb2+
B.铅蓄电池放电时,该电池两极质量均减少
C.铅蓄电池充电时,B极应与外电源负极相连
D.电解苦卤水时,a电极首先放电的是Br﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不可以用氢键来解释的是()
A.水是一种非常稳定的化合物
B.测量氟化氢分子量的实验中,发现实验值总是大于20
C.水结成冰后,体积膨胀,密度变小
D.氨气容易液化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示与对应叙述相符的是( ) 
A.一定条件下,X和Y反应生成Z,由图1推出该反应的方程式可表示为:X+3YZ
B.图2表示NaOH溶液滴加到0.1 mol/L的一元酸溶液得到的滴定曲线(常温下),该实验最好选取酚酞作指示剂
C.常温下,向NaOH溶液中逐滴加入等浓度的醋酸溶液,所得滴定曲线如图3所示.当7<pH<13时,溶液中c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+)
D.用硝酸银溶液滴定等浓度的A﹣、B﹣、C﹣的混合溶液(均可以与Ag+反应生成沉淀),由图4可确定首先沉淀的是A﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】进入冬季北方开始供暖后,雾霾天气愈发严重,各地PM2.5、PM10经常“爆表”.引发雾霾天气的污染物中,最为常见的是机动车尾气中的氮氧化物和燃煤产生的烟气.
(1)已知反应N2O4(g)2NO2(g)△H,随温度升高,混合气体的颜色变深.将一定量N2O4气体充入绝热容器一段时间后,研究压缩和拉伸活塞过程中混合气体的气体的透光率(气体颜色越浅,透光率越大)随时间变化情况.
下列说法能说明透光率不再发生改变的有 .
a.气体颜色不再改变 b.△H不再改变
c.v正(N2O4)=2v逆(NO2) d.N2O4的转化率不再改变
(2)用NH3催化还原NOx可以消除氮氧化物的污染.如图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),反应原理为:NO(g)+NO2(g)+2NH3(g)2N2(g)+3H2O(g).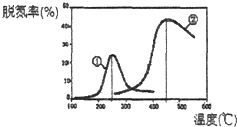
①该反应的△S0(填“>”、“=”或“<”).
②以下说法正确的是 .
A.第②种催化剂比第①种催化剂脱氮率高
B.相同条件下,改变压强对脱氮率没有影响
C.催化剂①、②分别适合于250℃和450℃左右脱氮
(3)用CH4催化还原NOx也可以消除氮氧化物的污染.
已知:CH4(g)的燃烧热为890kJ/mol,蒸发1mol H2O(l)需要吸收44kJ热量.
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=﹣1114kJ/mol
2NO(g)+O2(g)═2NO2(g)△H=﹣114kJ/mol
写出CH4催化还原NO2(g)生成N2和H2O(g)的热化学方程式: .
(4)在温度为T1℃和T2℃时,分别将0.5mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得NO2的物质的量随时间变化数据如下表:
时间/min | 0 | 10 | 20 | 40 | 50 |
T1 | 1.2 | 0.9 | 0.7 | 0.4 | 0.4 |
T2 | 1.2 | 0.8 | 0.56 | … | 0.5 |
①温度为T1℃时,0~20min内,v(CH4)= .
②T1T2(填“>”或“<”,下空同);判断理由是 .
③T1℃时,反应CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g)平衡常数K=
④温度为T2℃时,达平衡后,再向容器中加入0.5mol CH4和1.2mol NO2 , 达新平衡时CH4的转化率将 (填“增大”、“减小”或“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示转化关系(X代表卤素),说法不正确的是( ) 
A.2H(g)+2X(g)=2HX(g)△H3<0
B.途径Ⅰ生成HX的反应热与途径无关,所以△H1=△H2+△H3
C.途径Ⅰ生成HBr放出的热量比生成HCl的少,说明HBr比HCl稳定
D.Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com