
“84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶某品牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:
“84消毒液”:含25% NaClO、1 000 mL、密度1.19 g·cm-3,稀释100倍(体积比)后使用。
请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为_____mol·L-1。
(2)该同学取100 mL该品牌“84消毒液”稀释后用于消毒,稀释后的溶液中
c(Na+)≈_____mol·L-1(假设稀释后溶液密度为1.0 g·cm-3)。
(3)该同学参阅该品牌“84消毒液”的配方,欲用NaClO固体配制480 mL含25% NaClO的消毒液。下列说法正确的是_____。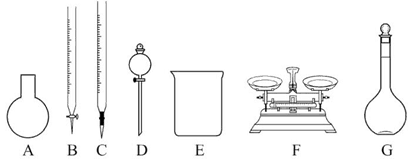
| A.如图所示的仪器中,有四种是不需要的,还需一种玻璃仪器 |
| B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制 |
| C.利用购买的商品NaClO来配制可能导致结果偏低 |
| D.需要称量的NaClO固体质量为143 g |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
“84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶某品牌“84消毒液”,
并查阅相关资料和消毒液包装说明得到如下信息:
“84消毒液”:含25% NaClO、1 000 mL、密度1.19 g·cm-3,稀释100倍(体积比)后使用。请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为________mol·L-1。
(2)该同学取100 mL该品牌“84消毒液”稀释后用于消毒,稀释后的溶液中c(Na+ )≈________mol·L-1(假设稀释后溶液密度为1.0 g·cm-3)。
(3)该同学参阅该品牌“84消毒液”的配方,欲用NaClO固体配制480 mL含25% NaClO的消毒液。下列说法正确的是________。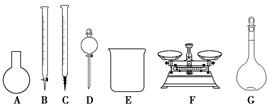
| A.如图所示的仪器中,有四种是不需要的,还需一种玻璃仪器 |
| B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制 |
| C.利用购买的商品NaClO来配制可能导致结果偏低 |
| D.需要称量的NaClO固体质量为143 g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知硫酸、氨水的密度与所加水的量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
| | 溶质的物质的量 浓度/mol·L-1 | 溶液的密度/g·cm-3 |
| 硫酸 | c1 | ρ1 |
| 氨水 | c2 | ρ2 |
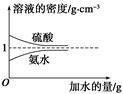
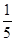 c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________
c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________ 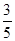 c2 mol·L-1(设混合后溶液的体积变化忽略不计)。
c2 mol·L-1(设混合后溶液的体积变化忽略不计)。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(Ⅰ)在室温下,向某一容积固定的真空容器内充入丁烷(气)和氧气,使容器内混合气的总压强达到p1,点火燃烧,氧气反应完全,冷却至室温后容器内气体的总压强为p2。
(1)若丁烷燃烧的生成物只有H2O(液)和CO2,则p2/p1= 。
(2)若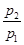 =0.64,则反应前混合气中丁烷的物质的量分数= 。
=0.64,则反应前混合气中丁烷的物质的量分数= 。
(Ⅱ)设阿伏加德罗常数为NA,在常温常压下气体的摩尔体积为Vm L·mol-1,O2和N2的混合气体a g含有b个分子,则c g该混合气体在常温常压下所占的体积应是 L。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某固体混合物含NH4I、NaHCO3、AlCl3、MgBr2、FeCl2中的几种,为确定该固体混合物的成分及各组成成分的物质的量之比,现进行如下实验。
实验Ⅰ:
(1)无色气体为 。
(2)该固体混合物的成分为 。
实验Ⅱ:取一定量的该固体混合物溶于水配成1 L溶液,并向该混合溶液中通入一定量的Cl2,测得溶液中几种阴离子(分别用A-、B-、C-表示)的物质的量与通入Cl2体积的关系如表所示。
| Cl2的体积 (标准状况下)/L | 2.8 | 5.6 | 11.2 |
| n(A-)/mol | 1.25 | 1.5 | 2 |
| n(B-)/mol | 1.5 | 1.4 | 0.9 |
| n(C-)/mol | a | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
把2.0mol/LCuSO4溶液和1.0mol/LH2SO4溶液等体积混合(假设混合后溶液的体积等于两溶液的体积之和)。
(1)溶液中H+的物质的量浓度为 ,SO42-的物质的量浓度为 。
(2)向混合溶液中加入足量的铁粉,经足够长的时间后,铁粉有剩余。此时,溶液中的Fe2+物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
按要求回答下列问题。
(1)SO2是形成酸雨的罪魁祸首。 64 g SO2的物质的量为 ,在标准状况下的体积约为 ,所含原子数为 。
(2)写出除去下列物质所含杂质(括号内为杂质)所用的试剂或方法:
①Na2CO3固体(NaHCO3) ②FeCl3溶液(FeCl2)
③Mg粉(Al) ④CO2(SO2)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
从含镁、钾盐湖水中蒸发最后得到产物中含光卤石(xKCl·yMgCl2·zH2O),它是制造钾肥和提取金属镁的重要原料,其组成可通过下列实验测定:
①准确称取5.550g样品溶于水,配成100.0mL溶液。
②将溶液分成二等份,在一份中加入足量的NaOH溶液至沉淀完全,过滤、洗涤、干
燥至恒重,得到白色固体0.580g。
③在另一份溶液中加入足量的硝酸酸化的AgNO3溶液至沉淀完全,过滤、洗涤、干燥
至恒重,得到白色固体4.305g。
(1)步骤②中检验白色固体已洗净的方法是: 。
(2)已知某温度下Mg(OH)2的Ksp=6.4×l0?12,当溶液中c(Mg2+)≤1.0×10?5mol·L?1可视为沉淀完全,则此温度下应保持溶液中c(OH-)≥ mol·L?1。
(3)通过计算确定样品的组成(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在300 mL2mol/LH2SO4溶液中,溶质的质量是 ,此溶液中含H+的物质的量是 ,H+的物质的量浓度是 ,其中含有 个SO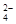 ,SO
,SO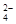 的物质的量浓度是 。
的物质的量浓度是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com