
| 酸 | H2C2O4 | HF | H2CO3 | H3BO3 |
| 电离平衡常数Ka | Ka1=5.9×10-2 Ka2=6.4×10-5 | 未知 | Ka1=4.2×10-7 Ka2=5.6×10-11 | 5.8×10-10 |
分析 (1)①HF在溶液中电离出氢离子和氟离子,证明HF存在电离平衡即可;
②弱酸加水稀释会存进弱酸的电离,稀释10n倍,pH变化小于n个单位;
③根据Ka=$\frac{c({F}^{-})×c({H}^{+})}{c(HF)}$计算;
(2)①由信息可知为一元酸,H3BO3电离除生成B(OH)4-外还生成H+;
②根据酸电离出氢离子的难易程度判断;
(3)草酸的第二电离常数大于碳酸的第一电离常数,所以NaHC2O4 溶液中加入少量的Na2CO3溶液,会生成二氧化碳.
解答 解:(1)①HF在溶液中电离出氢离子和氟离子,溶液显酸性,滴入2 滴紫色石蕊试液,显红色,再加入NaF 固体,HF的电离平衡向逆方向移动,氢离子浓度减小,溶液的红色变浅,证明HF存在电离平衡,即HF为弱酸;
故答案为:红色变浅;
②乙同学取10ml未知浓度的HF 溶液,测其pH 为a,然后用蒸馏水稀释至1000mL,体积增大102倍,弱酸加水稀释会存进弱酸的电离,稀释102倍,pH变化小于2个单位,所以稀释后pH=b<a+2;
故答案为:a+2;
③用pH 试纸测得室温下0.10mol•L-1的HF 溶液的pH为2,则c(H+)=0.01mol/L,则Ka=$\frac{c({F}^{-})×c({H}^{+})}{c(HF)}$=$\frac{0.01×0.01}{0.1-0.01}$≈1.0×10-3;
故答案为:1.0×10-3;
(2)①由信息可知为一元酸,H3BO3电离除生成B(OH)4-外还生成H+,其方程式为:H3BO3+H2O?B(OH)4-+H+,
故答案为:H3BO3+H2O?B(OH)4-+H+;
②由表中数据可知,H2C2O4的第一电离和第二步电离程度都大于H3BO3,所以NaOH先与H2C2O4、HC2O4-反应,然后与H3BO3反应;
故答案为:H2C2O4、HC2O4-、H3BO3;
(3)草酸的第二电离常数大于碳酸的第一电离常数,所以NaHC2O4 溶液中加入少量的Na2CO3溶液,会生成二氧化碳,其化学方程式为:2HC2O4-十CO32-=2C2O42-+H2O+CO2↑;
故答案为:2HC2O4-十CO32-=2C2O42-+H2O+CO2↑.
点评 本题考查了弱电解质的电离、电离常数的应用和计算、电离方程式等,题目难度中等,注意把握电离常数与酸的酸性强弱的关系,侧重于考查学生的分析能力和计算能力.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:选择题

| A. | 图②中Cr2O72-离子向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去 | |
| B. | 图②的电解池中,有0.084 g阳极材料参与反应,阴极会有33.6 mL的气体产生 | |
| C. | 图①中发生的还原反应是:Mg2++ClO-+H2O+2e-═Cl-+Mg(OH)2↓ | |
| D. | 若图①中3.6 g镁溶解产生的电量用以图②废水处理,理论可产生10.7 g氢氧化铁沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度相同、体积相同的O2和N2 | B. | 质量相等、密度不等的N2和C2H4 | ||
| C. | 压强相等、温度相等的CO和C2H4 | D. | 压强相同、体积相同的N2和O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下两种气体的体积之比等于摩尔质量之比 | |
| B. | 同温同压下两种气体的物质的量之比等于密度之比 | |
| C. | 同温同压下两种质量相同的气体其体积比之比等于摩尔质量之比 | |
| D. | 同温同体积下两种气体的物质的量之比等于压强之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | lmolC2H8N2中含有lmolN2 | |
| B. | 偏二甲肼的摩尔质量为60g | |
| C. | 偏二甲肼是比液氢更环保的燃料 | |
| D. | 偏二甲肼燃烧时能放出大量的热和气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯分子中3个碳原子都是sp3杂化 | |
| B. | 每个丙烯分子有7个σ键,1个π键 | |
| C. | 丙烯分子是存在非极性键和极性键的极性分子 | |
| D. | 丙烯分子为手性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
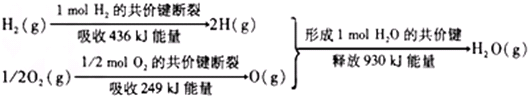
| A. | 氢气跟氧气反应生成水的同时释放能量 | |
| B. | 氢气跟氧气反应生成水的同时吸收能量 | |
| C. | 1 mol H2跟1/2 mol O2反应生成1 mol H2O释放能量不一定是245 kJ | |
| D. | 2 mol H2(g)跟1 mol O2(g)反应生成2 mol H2O(g)释放能量490 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com