
下列陈述I、II正确且有因果关系的是
| 选项 | 陈述I | 陈述II |
| A | SO2有漂白性 | SO2可使酸性高锰酸钾溶液褪色 |
| B | 硫酸铜是强酸弱碱盐 | 蒸干CuSO4溶液可以得到Cu(OH)2固体 |
| C | SO2是酸性氧化物 | 将SO2通入BaCl2溶液可生成BaSO3沉淀 |
| D | 氢氧化铝显两性 | 向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaOH溶液,沉淀消失 |
D
解析试题分析:陈述I、II 均正确,使有颜色的有机物溶液褪色才能说明二氧化硫的漂白性,使有颜色的高锰酸钾溶液、溴水、碘水、氯水等无机强氧化剂褪色,只能说明二氧化硫的还原性,因此I、II无因果关系,故A项错误;陈述I正确,CuSO4是强酸弱碱盐,加热时能水解生成氢氧化铜和硫酸,硫酸是高沸点、难挥发的酸,因此硫酸与氢氧化铜发生中和反应生成硫酸铜和水,水易挥发,硫酸铜难挥发,所以蒸干硫酸铜溶液可以得到无水硫酸铜固体,则陈述II错误,故B项错误;陈述I正确,二氧化硫是酸性氧化物,溶于水时发生反应生成亚硫酸,亚硫酸的酸性比盐酸弱,因此亚硫酸不能与氯化钡溶液反应,不可能得到亚硫酸钡沉淀,则陈述II错误,故C项错误;陈述I正确,氢氧化铝具有两性,既能与强碱溶液反应,又能与强酸溶液反应,但不能与弱酸或弱碱溶液反应,氨水是弱碱溶液,其碱性比氢氧化铝强,则氯化铝溶液与氨水能反应生成白色的氢氧化铝沉淀,NaHSO4是强电解质,能完全电离,其溶液具有强酸性,能溶解少量的氢氧化铝沉淀,则陈述II正确,且I、II有因果关系,故D项正确。
考点:本题考查元素化合物的性质,涉及二氧化硫的漂白性和还原性、硫酸铜的水解反应原理及原因、亚硫酸的酸性及亚硫酸钡的主要性质、氢氧化铝的两性及制备、氨水的弱碱性、硫酸氢纳溶液的强酸性等。


 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:单选题
下表各组物质之间通过一步反应不可以实现如图所示转化关系的是 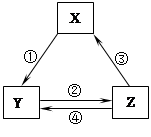
| 选项 | X | Y | Z | 箭头上所标 数字的反应条件 |
| A | SiO2 | Na2SiO3 | H2SiO3 | ①与Na2CO3熔融 |
| B | NaCl | NaHCO3 | Na2CO3 | ②加热 |
| C | N2 | NO2 | HNO3 | ③加热 |
| D | C | CO | CO2 | ④灼热炭粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列反应与酸性氧化物的通性无关的是
| A.实验室用碱石灰吸收SO2 |
| B.Na2O2与水反应制备氧气 |
| C.N2O5与水反应制备HNO3 |
| D.CO2与澄清石灰水作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列化学实验事实的描述及其结论都正确的是
| A.将饱和氯水滴到淀粉碘化钾试纸上,试纸先变蓝后变白,说明氯水具有漂白性 |
| B.将SO2通入含HClO的溶液中,生成H2SO4,说明HClO酸性比H2SO4强 |
| C.FeCl3溶液可以腐蚀印刷电路板上的Cu,说明Fe的金属活动性大于Cu |
| D.铝箔在酒精灯火焰上加热熔化但不滴落,说明铝箔表面氧化铝熔点高于铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关物质性质和应用叙述正确并且有因果关系的是
| A.烧碱具有碱性,能用于治疗胃酸过多 |
| B.焦炭具有还原性,一定条件下能将二氧化硅还原为硅 |
| C.浓硝酸具有强氧化性,能和浓氨水反应产生白烟 |
| D.二氧化硫具有漂白性,与氯水混合使用漂白效果更好 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列各组反应,最终一定能得到白色沉淀的是
| A.向Na2SiO3溶液中加入稀盐酸 |
| B.向CuSO4溶液中加入NaOH溶液 |
| C.向FeCl3溶液中加入过量NaOH溶液 |
| D.向Al2(SO4)3溶液中加入过量NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知甲、乙、丙分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
Ⅰ.若甲的化学式为RCl3,其溶液在加热蒸干并灼烧时可发生反应:
a.甲+H2O 乙+丙 b.乙
乙+丙 b.乙 氧化物+H2O
氧化物+H2O
①若甲为某用途广泛的金属元素的氯化物,其溶液在上述变化中生成的氧化物为红棕色粉末,则甲发生a反应的化学方程式为:
②若甲为某短周期金属元素的氯化物,则该金属在周期表中的位置是: ;
若向30 mL 1 mol/L的甲的溶液中逐渐加入浓度为4 mol/L的NaOH溶液,若产生0.78 g白色沉淀,则加入的NaOH溶液的体积可能为 (选填编号).
| A.3 mL | B.7.5 mL | C.15 mL | D.27.5 mL |
 丙。则:
丙。则:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com