
| A. | C2H2 | B. | C2H4 | C. | C3H4 | D. | C4H6 |
分析 根据某烃1mol最多能和2mol HCl加成,则分子中含有2个C=C键或1个C≡C,1mol氯代烃l mol能和6mol Cl2发生取代反应,说明1个氯代烃中引入6个Cl原子,加成时1个某烃分子已引入2个Cl原子形成氯代烃,所以1个最后的有机化合物中分子共含有8个Cl原子,以此来解答.
解答 解:某烃1mol最多能和2mol HCl加成,则分子中含有2个C=C键或1个C≡C,1mol氯代烃l mol能和6mol Cl2发生取代反应,说明1个氯代烃中引入6个Cl原子,加成时1个某烃分子已引入2个Cl原子形成氯代烃,所以1个最后的有机化合物中分子共含有8个Cl原子,则C原子数目为3,故该烃的分子式为为C3H4,故选C.
点评 本题考查有机物的推断,明确加成反应与取代反应的实质是解答本题的关键,注意1mol氯代烃l mol能和6mol Cl2发生取代反应,说明1个氯代烃中引入6个Cl原子.


科目:高中化学 来源: 题型:选择题
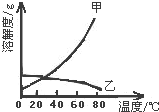 甲乙两种固体的溶解度曲线如图所示.有一个大烧杯中装着含有甲和乙的两种饱和溶液,而且杯中还有少量甲和乙的固体存在.现将温度由80℃降到20℃.下列说法错误的是( )
甲乙两种固体的溶解度曲线如图所示.有一个大烧杯中装着含有甲和乙的两种饱和溶液,而且杯中还有少量甲和乙的固体存在.现将温度由80℃降到20℃.下列说法错误的是( )| A. | 杯中固体甲增多、固体乙减少 | |
| B. | 杯中一定有固体甲而不一定有固体乙 | |
| C. | 溶液中溶质甲减少、溶质乙增多 | |
| D. | 甲和乙的两种溶液仍然是饱和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 以下是生活中常见的物品:a.玻璃杯 b.电源插座 c.废旧干电池 d.废报纸 e.尼龙绳 f.轮胎 g.铁锅
以下是生活中常见的物品:a.玻璃杯 b.电源插座 c.废旧干电池 d.废报纸 e.尼龙绳 f.轮胎 g.铁锅查看答案和解析>>
科目:高中化学 来源: 题型:解答题
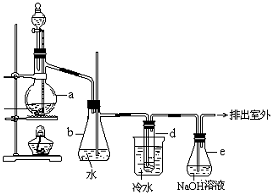 醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备溴乙烷的装置如图所示,其中锥形瓶b是安全瓶,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4℃,密度为1.43g/mL;
醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备溴乙烷的装置如图所示,其中锥形瓶b是安全瓶,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4℃,密度为1.43g/mL;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于反应Na2SO3+H2SO4═Na2SO4+SO2↑+H2O,增大体系的压强 | |
| B. | 对于N2(g)+3H2(g)?2NH3(g),容器体积固定不变时,充入Ar | |
| C. | 对于N2(g)+3H2(g)?2NH3(g),容器体积固定不变时,充入N2 | |
| D. | 对于N2(g)+3H2(g)?2NH3(g),容器气体压强不变时,充入Ar |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 消去反应 | C. | 加成反应 | D. | 加聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com