
| A. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ | B. | 4Fe(OH)2+O2+2H2O=4Fe(OH)3 | ||
| C. | 2F2+2H2O=4HF+O2↑ | D. | 2Na+2H2O=2NaOH+H2↑ |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
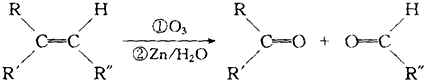
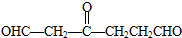 ,则该烯烃的结构不可能是( )
,则该烯烃的结构不可能是( )| A. | 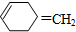 | B. | 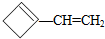 | C. | 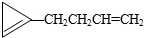 | D. | 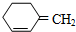 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
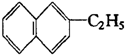 属于萘的同系物,则萘和萘的同系物分子组成通式为CnH2n-12 (n≥10).
属于萘的同系物,则萘和萘的同系物分子组成通式为CnH2n-12 (n≥10). ②丙的结构简式为
②丙的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀有气体最外层电子数均为8个,很稳定 | |
| B. | 稀有气体的电子层数比较多,很稳定 | |
| C. | 稀有气体的最外层电子数均达到稳定结构 | |
| D. | 稀有气体的原子核所带电荷较多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com