
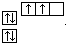
 ,
, ;
;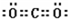 ,其为直线形分子,中心C原子采取商品杂化方式,故答案为:
,其为直线形分子,中心C原子采取商品杂化方式,故答案为: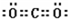 ;直线;sp;
;直线;sp;

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
| A、碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O |
| B、向氢氧化钠溶液中滴入盐酸:OH-+H+=H2O |
| C、澄清石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O |
| D、铁钉放入硫酸铜溶液中:Fe+3Cu2+=2Fe3++3Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | |
| Z | W |
| A、原子半径:Z>X>Y |
| B、最高价氧化物对应水化物的酸性:Z>W |
| C、W的单质是制取盐酸的原料之一 |
| D、X、W的氢化物相遇会产生白烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:
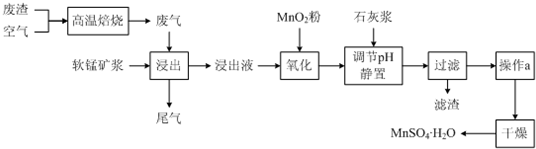
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:
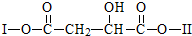 (其中I、II为未知部分的结构)为推测X的分子结构,进行如图的转化:
(其中I、II为未知部分的结构)为推测X的分子结构,进行如图的转化: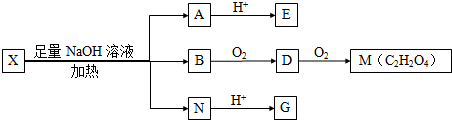
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
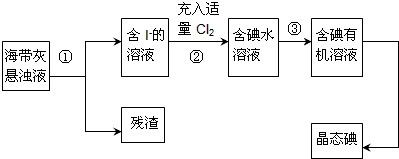
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com