
ij��������FeCl3��Һ��ʴ����ͭ�ľ�Ե��������·�壬һʵ��С��Ըó�������·�����õķ�Һ���з�����ȡ50��0 mL��Һ�������м���0��64 g Cu������ͭȫ���ܽ⡣��ȡ50��0 mL��Һ�������м���������AgNO3����������43��05 g������˵����ȷ���ǣ� ��
| A��ԭ��Һ�к��еĽ���������ֻ��Fe2����Cu2�� |
| B���ù���ԭ��ʹ�õ�FeCl3��Һ�����ʵ���Ũ��ԼΪ2 mol/L |
| C������500 mL��Һ�м���������ϡHNO3��Һ���ڱ���²���NO����4��48 L����ԭ��Һ��Fe2����Cu2�������ʵ���Ũ��֮��Ϊ2:1 |
| D������ʹ�����軯����Һ����÷�Һ���Ƿ���Fe2�� |
BC
��������������������Ϣ��֪,ͭ��0��01molȫ���ܽ⣬Ӧ����0��02molFe3+��A���Եڶ�����Һ����,��֪������=�Ȼ���=43��05/(108+35��5)= 0��3mol ���ù���ԭ��ʹ�õ�FeCl3��Һ�����ʵ���Ũ��ԼΪC=0��1 mol /0��05 L ="2" mol/L��B��ȷ������500ml������0��2molNO,��ô��50ml��Ӧ�ÿ��Եõ�0��06mol���ӣ���0��06molӦ����Fe2+ ,��Һ��������0��02molFe3+, 0��06molFe2+ ,0��3mol Cl-������Ϊ�����Һ����Ӧ����FeCl3��Cu�ķ�Ӧ����,2Fe3+ +Cu=2Fe2+ +Cu2+���Fe2+=2Cu2+��0��03molCu �ɵ����غ�, 0��3-0��06��2-0��03��2=0��12,����Ӧ����0��04molFe3+������������,0��03mol CuCl2 ,0��06molFeCl2 ,0��04mol FeCl3����C����ȷ�ģ�Dֻʹ�����軯����Һ������÷�Һ���Ƿ���Fe2��������
���㣺��Һ�ɷֵķ����ͼ���


 �����������һ��һ��ϵ�д�
�����������һ��һ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�⻯��ͭ(CuH)��һ�ֲ��ȶ����ʣ�����������ȼ�գ�Ҳ�����ᷴӦ����CuSO4��Һ�͡�ij���ʡ���40��50��ʱ��Ӧ�ɲ������������й������д������
| A����ij���ʡ����л�ԭ�� |
| B��CuH�����ᷴӦ�����ܲ���H2 |
| C��CuH��������ϡ���ᷴӦ��CuH+ 3H++ NO3-�� Cu2+�� NO���� 2H2O |
| D��CuH��������ȼ�գ�CuH+ Cl2�� CuCl+ HCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�⻯��ͭ��CuH����һ�ֲ��ȶ����ʣ�����������ȼ�գ�Ҳ�����ᷴӦ����CuSO4��Һ�͡�ij���ʡ���40��50��ʱ��Ӧ�ɲ������������й������д�����ǣ�������
| A���⡰ij���ʡ����л�ԭ�� |
| B��CuH�����ᷴӦ�����ܲ���H2 |
| C��CuH��������ϡ���ᷴӦ��CuH+3H++NO3��=Cu2++NO��+2H2O |
| D��CuH��������ȼ�գ�CuH+Cl2=CuCl+HCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���ݱ�����Ϣ�жϣ�����ѡ���ȷ����
| ��� | ��Ӧ�� | ���� |
| �� | KMnO4��H2O2��H2SO4 | K2SO4��MnSO4�� |
| �� | Cl2��FeBr2 | FeCl3��FeBr3 |
| �� | MnO4-�� | Cl2��Mn2���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�������µķ�Ӧ���̣�һ��Ҫ�������������ܹ�ʵ�ֵ��ǣ� ��
| A��O2��H2O | B��SO2��SO42�� | C��H2SO4��CuSO4 | D��HNO3��NO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����������ײʱ����ȫ�����з�����Ӧ10NaN3+2KNO3 = K2O+5Na2O+16N2�������ڸ÷�Ӧ�������ж���ȷ����
| A��NaN3�е�Ԫ�صĻ��ϼ�Ϊ��3 |
| B���������ͻ�ԭ����ͬһ���� |
| C����Ӧ��������ת��1mol���ӣ������2��24L���壨��״���� |
| D���������ĵ�ԭ�������ɵĵ������Ӹ���֮��Ϊ15:8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����������NF3������ʾ��ֻ�����ּ�̬��-1��0�������ӹ�ҵ�������ĵ����ӿ�ʴ���壬���ڳ�ʪ�Ļ������ܷ�����Ӧ��3NF3+5H2O��2NO+HNO3+9HF�������йظ÷�Ӧ��˵����ȷ����
| A��NF3����������H2O�ǻ�ԭ�� |
| B����ԭ���������������ʵ���֮��Ϊ2:1 |
| C��������0.2molHNO3����ת��0.2mol���� |
| D����1molNF3��������Ӧת�Ƶ�����Ϊ2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
ij��Һ�к��д�����Clһ��Brһ��Iһ������l L�û����Һ��ͨ��һ������Cl2����Һ��Cl-��Brһ��Iһ�����ʵ�����ͨ��Cl2���������״�����Ĺ�ϵ���±���ʾ��ԭ��Һ��Clһ��Brһ��Iһ�����ʵ���Ũ��֮��Ϊ( )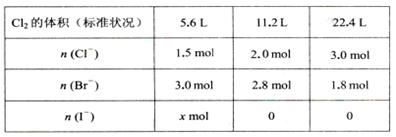
| A��5:15:4 | B��5:12:4 | C��15 : 30 : 8 | D���������㣬������ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com