
【题目】向1L的密闭容器中加入1molX、0.3molZ和一定量的Y三种气体。一定条件下发生反应,各物质的浓度随时间的变化如图甲所示。图乙为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。下列说法不正确的是( )
图甲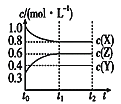 图乙
图乙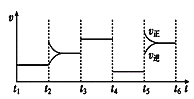
A.t4时改变的条件为增大容器容积以减小压强
B.该反应的化学方程式为2X(g)+Y(g)![]() 3Z(g) ΔH>0
3Z(g) ΔH>0
C.若t0 =0,t1=10s,则t0~t1阶段的平均反应速率为υ(Y)=0.03mol·L-1·s-1
D.反应物X的转化率t6点比t4点高
【答案】C
【解析】
由图甲可知X为反应物,Z为生成物, X的浓度变化量为1.0mol/L-0.8mol/L=0.2mol/L,Z的浓度的变化0.6mol/L-0.3mol/L=0.3mol/L,X与Z的化学计量数之比为2:3;图乙为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件,根据图乙,t2时改变的条件为增大某物质的浓度;t3时改变条件正、逆反应速率都加快,但平衡不移动,则改变的条件为使用催化剂;t4时改变条件正、逆反应速率都减慢,但平衡不移动,则改变的条件为减小压强,且反应前后气体的体积不变,因此Y为反应物,反应方程式为2X(g)+Y(g)![]() 3Z(g);t5改变条件,正、逆反应速率都加快,平衡正向移动,则改变的条件为升高温度且正反应为吸热反应。
3Z(g);t5改变条件,正、逆反应速率都加快,平衡正向移动,则改变的条件为升高温度且正反应为吸热反应。
由图甲可知X为反应物,Z为生成物, X的浓度变化量为1.0mol/L-0.8mol/L=0.2mol/L,Z的浓度的变化0.6mol/L-0.3mol/L=0.3mol/L,X与Z的化学计量数之比为2:3;图乙为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件,根据图乙,t2时改变的条件为增大某物质的浓度;t3时改变条件正、逆反应速率都加快,但平衡不移动,则改变的条件为使用催化剂;t4时改变条件正、逆反应速率都减慢,但平衡不移动,则改变的条件为减小压强,且反应前后气体的体积不变,因此Y为反应物,反应方程式为2X(g)+Y(g)![]() 3Z(g);t5改变条件,正、逆反应速率都加快,平衡正向移动,则改变的条件为升高温度且正反应为吸热反应;
3Z(g);t5改变条件,正、逆反应速率都加快,平衡正向移动,则改变的条件为升高温度且正反应为吸热反应;
A.根据上述分析,t4时改变的条件为增大容器容积以减小压强,反应速率减慢,平衡不移动,A项正确;
B.该反应的化学方程式为:2X(g)+Y(g)![]() 3Z(g) ΔH>0,B项正确;
3Z(g) ΔH>0,B项正确;
C. 因浓度的变化量之比等于化学计量数之比,X的浓度变化量为1.0mol/L-0.8mol/L=0.2mol/L,Z的浓度的变化0.6mol/L-0.3mol/L=0.3mol/L,则Y的浓度的变化量为0.1mol/L,υ(Y)=![]() =
=![]() =0.01mol·L-1·s-1,C项错误;
=0.01mol·L-1·s-1,C项错误;
D. 由图可知t5-t6为升高温度,平衡正向移动,因此X的转化率t6点比t4点高,D项正确;
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中的pH判断或各微粒浓度关系,不正确的是( )
A.将![]() 的
的![]() 溶液与
溶液与![]() 溶液充分混合,若混合后溶液的体积为10mL,则混合液的
溶液充分混合,若混合后溶液的体积为10mL,则混合液的![]()
B.将![]() 的某一元酸HA溶液和
的某一元酸HA溶液和![]() 溶液等体积混合,混合液pH大于7,则反应后的混合液中:
溶液等体积混合,混合液pH大于7,则反应后的混合液中:![]()
C.pH相等的![]()
![]()
![]() 溶液中,
溶液中,![]() 大小关系:
大小关系:![]()
D.常温下,![]() 的
的![]() 和NaClO的混合溶液中:
和NaClO的混合溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是![]()
A.反应![]() 室温下不能自发进行,则该反应的
室温下不能自发进行,则该反应的![]()
B.铅蓄电池放电过程中,正极质量增加,负极质量减小
C.![]() 下,在
下,在![]() 稀溶液中,加水,
稀溶液中,加水,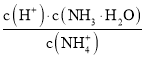 的值不变
的值不变
D.在NaHS溶液中,滴入少量![]() 溶液产生黑色沉淀,
溶液产生黑色沉淀,![]() 水解程度增大,pH增大
水解程度增大,pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮水安全在人们生活中占有极为重要的地位,某研究小组提取三处被污染的水源进行了分析,给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质。A、B、C、D、E五种常见化合物都是由下表中的离子形成:
阳离子 | K+、Na+、 Cu2+、Al3+ |
阴离子 | SO42-、HCO3-、NO3-、OH- |
为了鉴别上述化合物,分别进行以下实验,其结果如下所示:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃片);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出B、D的化学式:B:____________、D:________。
(2)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为____________。
(3)写出实验②发生反应的离子方程式:___________________、_________________。
(4)C常用作净水剂,用离子方程式表示其净水原理:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图1所示。下列说法正确的是
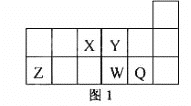
A. 元素X与元素Z的最高正化合价之和的数值等于8
B. 原子半径的大小顺序为:rX>rY>:rZ>rW>rQ
C. 离子Y2-和Z 3+的核外电子数和电子层数都不相同
D. 元素W的最高价氧化物对应的水化物的酸性比Q的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液分别滴定浓度均为![]()
![]() 的三种酸
的三种酸![]() 、HB和
、HB和![]() 溶液,滴定的曲线如图所示。下列判断不正确的是
溶液,滴定的曲线如图所示。下列判断不正确的是![]()
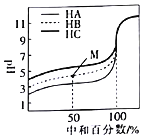
A.三种酸的电离平衡常数:![]()
B.滴定至M点时,溶液中:![]()
![]()
C.![]() 时,三种溶液中:
时,三种溶液中:![]()
![]()
D.当中和百分数达到![]() 时,三种溶液中:
时,三种溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4mol A气体和2mol B气体置于1L的密闭容器中,混合后发生如下反应:2A(g)+B(g)=2C(g)+D(s)。若经2s后测得C的浓度为1.8mol/L,下列说法正确的是
A.2s时物质A的浓度为0.9mol/L
B.用物质D表示的反应速率为0.45mol/(L·s)
C.用物质A表示的反应速率为1.8mol/(L·s)
D.2s时物质B的浓度为1.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅陶瓷能代替金属制造发动机的耐热部件。工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4(s)+12HCl(g) △H<0。若在恒压绝热容器中反应,下列选项表明反应一定已达化学平衡状态的是( )
Si3N4(s)+12HCl(g) △H<0。若在恒压绝热容器中反应,下列选项表明反应一定已达化学平衡状态的是( )
A. 容器的温度保持不变 B. 容器的压强保持不变
C. υ正(N2)=6υ逆(HCl) D. 容器内的气体c(N2)∶c(H2)∶c(HCl)=1∶3∶6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为__,3d能级上的未成对的电子数为__。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是__。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为__,提供孤电子对的成键原子是__。
③氨的沸点___(填“高于”或“低于”)膦(PH3),原因是__;氨是__分子(填“极性”或“非极性”),中心原子的轨道杂化类型为__。
(3)单质铜及镍都是由__键形成的晶体:元素铜与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是__。
(4)某镍白铜合金的立方晶胞结构如图所示。
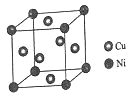
①晶胞中铜原子与镍原子的数量比为__。
②若合金的密度为dg/cm3,晶胞参数a=__nm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com