
元素及其化合物丰富了物质世界,下列说法正确的是
A.铜在冷的浓硫酸中会钝化,所以把铜放入冷的浓硫酸中无明显现象
B.NaOH溶液和AlCl3溶液相互滴加的现象不同
C.金属比非金属易失电子,所以金属可以置换非金属,而非金属不能置换金属
D.Al与热水反应困难,故活泼性不及Al的金属在任何条件下均不能与H2O发生反应
科目:高中化学 来源:2015届安徽省高三第一次联考化学试卷(解析版) 题型:选择题
下列选项中有关离子方程式的书写正确的是( )
A.过氧化钠固体与水反应:2O22-+2H2O=4OH-+O2↑
B.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O
C.过量的CO2通入Ca(ClO)2溶液中:ClO-+CO2+H2O=HCO3-+HClO
D.硫化钠水溶液呈碱性的原因:S2-+2H2O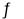 H2S+2OH-
H2S+2OH-
查看答案和解析>>
科目:高中化学 来源:2015届安徽省江淮十校高三11月联考化学试卷(解析版) 题型:选择题
“暖冰”是韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成的。某老师在课堂上做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成含有少量KSCN 的FeCl2溶液,则溶液呈血红色。则下列说法中不正确的是
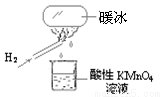
A.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
B.水凝固形成20℃时的“暖冰”所发生的变化是化学变化
C.该条件下H2燃烧生成了既具有氧化性又具有还原性的物质
D.该条件下H2燃烧的产物中可能含有一定量的H2O2
查看答案和解析>>
科目:高中化学 来源:2015届宁夏银川市高三上学期期中考试化学试卷(解析版) 题型:选择题
某溶液中含有的溶质是FeBr2、FeI2,若向该溶液中通入一定量的氯气,再向反应后的溶液中滴加少量的KSCN溶液,结果溶液变为红色,则下列叙述中正确的是
①原溶液中Br-一定被氧化
②通入氯气后原溶液中的Fe2+一定被氧化
③不能确定通入氯气后的溶液中是否存在Fe2+
④若取少量所得溶液,加入CCl4,静置,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中Fe2+、Br-均被完全氧化
A.②③④ B.①②③ C.①③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2015届宁夏银川市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列解释事实的化学方程式或离子方程式,不正确的是
A.用FeSO4除去酸性废水中的Cr2O72-:Cr2O72- + Fe2+ + 14H+ == 2Cr3+ + Fe3+ + 7H2O
B.向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+H2O+CO2===2HClO+CaCO3↓
C.用CaSO4治理盐碱地:CaSO4(s) + Na2CO3(aq) CaCO3(s) + Na2SO4(aq)
CaCO3(s) + Na2SO4(aq)
D.工业上可用电解法制备Mg:MgCl2(熔融)  Mg + Cl2↑
Mg + Cl2↑
查看答案和解析>>
科目:高中化学 来源:2015届宁夏银川市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列物质与常用危险化学品的类别不对应的是
A.H2SO4、NaOH——腐蚀品 B.CH4、C2H4——易燃液体
C.CaC2、Na——遇湿易燃物品 D.KMnO4、K2Cr2O7——氧化剂
查看答案和解析>>
科目:高中化学 来源:2015届宁夏高三年级第二次月考理综化学试卷(解析版) 题型:填空题
(14分)
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:
反应C+G B+H能放出大量的热,G是红综色固体粉末;
B+H能放出大量的热,G是红综色固体粉末;
②I是一种常见的温室气体,它和E可以发生反应:2E+I 2F+D,F中的E元素的质量分数为60%.
2F+D,F中的E元素的质量分数为60%.
回答问题:
(1)①中反应的化学方程式为____________________________________
(2) 1.6g G 溶于盐酸,得到的溶液与铜粉完全反应,至少需要铜粉_______克
(3) C与过量NaOH溶液反应的离子方程式为________________________,反应后的溶液与过量的化合物I反应的离子方程式为________________________________
(4) E与I反应的化学方程式为__________________________________
(5) 写出H物质在工业上的一种用途_____________。
(6)将一定量的B完全溶于过量盐酸中,然后通入0.005mol Cl2,再加入0.01mol重铬酸钾晶体(K2Cr2O7),恰好使溶液中B2+全部转化为B3+,铬元素本身被还原为+3价铬离子。通过计算确定原B的物质的量为( )
A.0.01mol B.0.03mol C.0.04mol D.0.07mol
查看答案和解析>>
科目:高中化学 来源:2015届宁夏高三上学期期中考试理科综合化学试卷(解析版) 题型:选择题
电解饱和食盐水,当阴极附近有0.4 mol NaOH生成时,阳极放出
A.0.2 mol H2 B.0.2 mol Cl2
C.O.4 mol H2 D.0.4 mol Cl2
查看答案和解析>>
科目:高中化学 来源:2015届四川省2015届高三9月理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B.通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动
C.溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,,即布朗运动
D.电解MgCl2饱和溶液,可制得金属镁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com