
| A. | 苯、乙醇和乙酸都能发生取代反应 | |
| B. | 葡萄糖注射液不能产生丁达尔效应现象,不属于胶体 | |
| C. | 淀粉、油脂、蛋白质都能水解,但水解产物不同 | |
| D. | 白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去 |
分析 A.苯可在催化作用下生成溴苯、硝基苯等,乙醇含有羟基,乙酸含有羧基,可发生酯化反应;
B.葡萄糖注射液为水溶液,不具有胶体的性质;
C.淀粉水解生成葡萄糖,油脂水解高级脂肪酸和甘油,蛋白质水解生成氨基酸;
D.塑化剂和酒精互溶.
解答 解:A.苯可在催化作用下生成溴苯、硝基苯等,乙醇含有羟基,乙酸含有羧基,可发生酯化反应,都取代反应,故A正确;
B.胶体粒子直径介于1~100nm之间,而葡萄糖注射液为水溶液,不具有胶体的性质,故B正确;
C.淀粉水解生成葡萄糖,油脂水解高级脂肪酸和甘油,蛋白质水解生成氨基酸,都为水解反应,且产物不同,故C正确;
D.不溶性固体和液体可以处于过滤法分离,塑化剂和酒精互溶,所以不能通过过滤除去,且塑化剂有毒,故D错误.
故选D.
点评 本题综合考查有机物的结构和性质,侧重于学生的分析能力的考查,注意把握有机物的性质、用途,题目有利于培养学生良好的科学素养,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 将2mol Cl2通入到含1mol FeBr2的溶液中:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2正确;Cl2过量,Fe2+、Br-均被氧化 | |
| B. | 用Cu电极电解NaCl溶液阳极的电极反应式:2Cl--2e-═Cl2↑正确;Cl-优先于OH-放电 | |
| C. | 过量SO2通入到NaClO溶液中:SO2+H2O+ClO-═HClO+HSO3-正确;H2SO3的酸性强于HClO | |
| D. | Mg(HCO3)2溶液与足量的NaOH溶液反应:Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O正确;Mg(OH)2比MgCO3更难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对应简单离子半径的大小顺序为:D>B>A | |
| B. | C的最高价氧化物对应水化物的酸性比D的强 | |
| C. | A分别与B、C形成的化合物中化学键类型相同 | |
| D. | B、C单质均能和氢氧化钠溶液发生反应生成氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
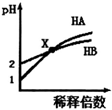
| A. | HB一定是弱酸 | |
| B. | 在x点,c(A-)=c(B-) | |
| C. | 稀释前由水电离出的c(H+),HB溶液是HA溶液的10倍 | |
| D. | 取x点时的两种酸溶液,分别中和等体积等浓度的NaOH溶液,消耗HA溶液的体积一定小于HB溶液的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
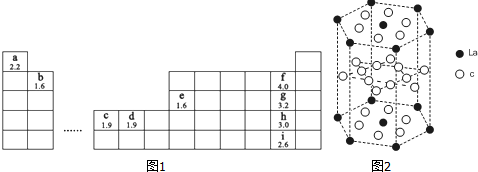
 .
.| 共价键 | f-f | g-g | h-h | i-i |
| 键能(kJ/mol) | 157 | 242.7 | 193.7 | 152.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| P1 | P2 | P3 | |
| T1 | 0.10 | 0.04 | 0.02 |
| T2 | 0.20 | 0.16 | 0.05 |
| T3 | 0.40 | 0.35 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液显酸性,可用于蚀刻印刷电路板 | |
| B. | Na2CO3溶液显碱性,可用于除锅垢中的硫酸钙 | |
| C. | MgO、Al2O3熔点高,可用于制作耐高温坩埚 | |
| D. | Na、K合金具有强还原性,可用于原子反应堆的导热剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 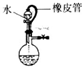 说明该装置气密性良好 | |
| B. | 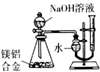 测定镁铝合金中铝的质量分数 | |
| C. | 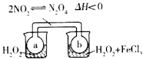 瓶中气体颜色变深,说明H202分解是吸热反应 | |
| D. | 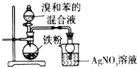 验证苯和溴发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
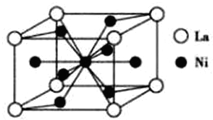 前36号元素A、B、C、D的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半充满结构,C最外层电子数是电子层数的三倍.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均全充满.请回答下列问题:
前36号元素A、B、C、D的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半充满结构,C最外层电子数是电子层数的三倍.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均全充满.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com