
分析 W、X、Y、Z为短周期内除稀有气体元素外的四种元素,它们的原子序数依次增大,Y的最外层电子数和W的最外层电子数相等,二者同主族,由于只有Y为金属元素,则Y只能处于IA族或ⅢA族,若Y为ⅢA族,结合原子序数可知W为B元素,Y为Al,令X、Z的原子序数均为a、b,则13+b=3(a+5),即b=3a+2,由于5<a,则b>17,Z不是短周期元素,不符合题意,故Y为IA族,结合原子序数可知W为H元素,Y为Na,令X、Z的原子序数均为a、b,则11+b=3(a+1),即b+8=3a,由原子序数、结合只有Y为金属,可得5≤a<10,14≤b≤17,则14≤3a-8≤17,故$\frac{22}{3}$≤a≤$\frac{25}{3}$,则a=8,故b=16,则X为O元素、Z为S元素.
解答 解:(1)W、X、Y、Z为短周期内除稀有气体元素外的四种元素,它们的原子序数依次增大,Y的最外层电子数和W的最外层电子数相等,二者同主族,由于只有Y为金属元素,则Y只能处于IA族或ⅢA族,若Y为ⅢA族,结合原子序数可知W为B元素,Y为Al,令X、Z的原子序数均为a、b,则13+b=3(a+5),即b=3a+2,由于5<a,则b>17,Z不是短周期元素,不符合题意,故Y为IA族,结合原子序数可知W为H元素,Y为Na,令X、Z的原子序数均为a、b,则11+b=3(a+1),即b+8=3a,由原子序数、结合只有Y为金属,可得5≤a<10,14≤b≤17,则14≤3a-8≤17,故$\frac{22}{3}$≤a≤$\frac{25}{3}$,则a=8,故b=16,则X为O元素、Z为S元素,
故答案为:H;O;Na;S;
(2)上述元素能组成的酸有:H2S、H2SO3、H2SO4,
故答案为:H2S、H2SO3、H2SO4;
(3)上述元素能组成的盐有:Na2S、NaHS、Na2SO3、NaHSO3、Na2SO4、NaHSO4、Na2S2O3,
故答案为:Na2S、NaHS、Na2SO3、NaHSO3、Na2SO4、NaHSO4、Na2S2O3.
点评 本题考查结构性质位置关系应用,侧重考查学生的分析推理能力,熟练掌握短周期元素及元素化合物组成等.


科目:高中化学 来源: 题型:解答题
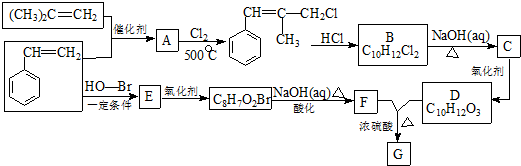
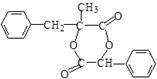 .
.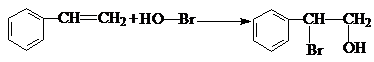 .
.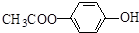 和
和 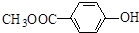 .
.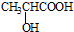 )的合成线路:
)的合成线路:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | 只有①②④ | C. | 只有①③⑤ | D. | 只有①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | |||
| Y | Z | R | |
| W |
| A. | 五种元素的原子最外层电子数一定大于2 | |
| B. | 五种元素一定都是非金属元素 | |
| C. | R 的最高价氧化物对应的水化物一定是强酸 | |
| D. | X的氢化物沸点一定比Z的氢化物沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E为元素周期表前四周期原子序数依次增大的元素,A原子核外有三个能级,每个能级上电子数相同,B原子的最外层p轨道的电子数为半充满结构,C、D为同主族元素,且D的原子序数是C的2倍,E2+的3d轨道上有10个电子.请回答下列问题:
已知A、B、C、D、E为元素周期表前四周期原子序数依次增大的元素,A原子核外有三个能级,每个能级上电子数相同,B原子的最外层p轨道的电子数为半充满结构,C、D为同主族元素,且D的原子序数是C的2倍,E2+的3d轨道上有10个电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
| 易溶于水,微溶于乙醇、两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
| 实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 体系pH | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
| 产率/% | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 | 5686. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,3-二甲基-4-乙基戊烷 | B. | 2-甲基-3,4-二乙基戊烷 | ||
| C. | 2,4-二甲基-3-乙基己烷 | D. | 2,3-二甲基戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于p区的同一中期的元素,M的价电子排布为nsnnp2n,E、M的原子核外的未成对电子数相等;M、Q同主族,QM2与GM2-具有相等的价电子总数;T为过渡元素,去原子核外没有成对电子.请回答下列问题:
E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于p区的同一中期的元素,M的价电子排布为nsnnp2n,E、M的原子核外的未成对电子数相等;M、Q同主族,QM2与GM2-具有相等的价电子总数;T为过渡元素,去原子核外没有成对电子.请回答下列问题: (若有配位键,请用“→”表示).E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因:从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.
(若有配位键,请用“→”表示).E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因:从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维应避免在强碱环境中使用 | |
| B. | 船体镀锌或镀锡均可保护船体,镀层破损后将立即失去保护作用 | |
| C. | 部分卤代烃可用作灭火剂 | |
| D. | 油脂皂化生成的高级脂肪酸钠是肥皂的有效成分 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com