
| A. | 60° | B. | 90° | C. | 120° | D. | 180° |
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①②③ | C. | ③⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
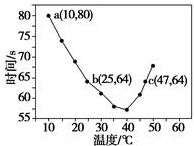
| A. | 40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 | |
| B. | 图中a点对应的NaHSO3反应速率为5.0×10-5 mol•L-1•s-1 | |
| C. | 图中b、c两点对应的NaHSO3反应速率相等 | |
| D. | 40℃之后,淀粉不宜用作该实验的指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
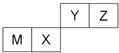
| A. | 离子半径Y<Z<M | |
| B. | Y的最高价氧化物对应水化物的酸性比X的强 | |
| C. | X的最简单气态氢化物的热稳定性比Z的大 | |
| D. | 单质沸点:M>X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径 A>B>D>C | |
| B. | 原子序数 d>c>b>a | |
| C. | 离子半径 C>D>B>A | |
| D. | 原子结构的最外层电子数目 A>B>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O原子发生sp杂化 | B. | O原子与H、Cl都形成σ键 | ||
| C. | 该分子为直线型分子 | D. | HClO分子的结构式是:H-Cl-O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 少用煤作燃料 | B. | 把工厂烟囱造高 | ||
| C. | 燃烧脱硫煤 | D. | 在已酸化的土壤中加石灰 | ||
| E. | 开发新能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
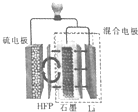 最近加拿大滑铁卢大学的科学家在锂硫(Li-S)电池技术上取得了一项重大突破,一种锂硫电池装置如图所示,其中的聚六氟丙烯(HFP)隔膜只允许Li+通过,已知放电时电池总反应为Li2S6+10Li=6Li2S,下列说法正确的是( )
最近加拿大滑铁卢大学的科学家在锂硫(Li-S)电池技术上取得了一项重大突破,一种锂硫电池装置如图所示,其中的聚六氟丙烯(HFP)隔膜只允许Li+通过,已知放电时电池总反应为Li2S6+10Li=6Li2S,下列说法正确的是( )| A. | 放电时,Li+向负极移动 | |
| B. | 充电时,阳极质量减少,阴极质量增加 | |
| C. | 放电时,正极的电极反应式为S62-+10e-=6S2- | |
| D. | 可用LiCl水溶液代替HFP隔膜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com