
分析 (1)假设溶液质量为100g,计算KOH、水的质量,再根据n=$\frac{m}{M}$计算KOH、水的物质的量,进而计算OH-与H2O数目之比;
(2)由化学式可知n(KCl)=n(K+),n(CaCl2)=n(Ca2+),据此判断KCl与CaCl2的物质的量之比,令氯化钙的物质的量为xmol,则氯化钾为2xmol,根据氯离子列方程计算x的值,进而计算各自的物质的量,再根据m=nM计算质量,进而计算总质量.
解答 解:(1)假设溶液质量为100g,则KOH的质量=100g×28%=28g,故水的质量=100g-28g=72g,故KOH的物质的量n=$\frac{m}{M}$=$\frac{28g}{56g/mol}$=0.5mol、水的物质的量n=$\frac{m}{M}$=$\frac{72g}{18g/mol}$=4mol,故溶液中OH-与H2O数目之比=0.5mol:4mol=1:8,
故答案为:1:8;
(2)由化学式可知n(KCl)=n(K+),n(CaCl2)=n(Ca2+),故n(KCl):n(CaCl2)=n(K+):n(Ca2+)=2:1,令氯化钙的物质的量为xmol,则氯化钾为2xmol,根据氯离子可知,2x+2x=1,解得x=0.25,故m(KCl)=0.25mol×2×74.5mol/L=37.25g,m(CaCl2)=0.25mol×111g/mol/L=27.75g,CaCl2的质量分数为:$\frac{27.75g}{27.75g+37.25g}$=42.7%,故含1mol氯离子的该混合物的质量为37.25g+27.75g=65g,
故答案为:42.7%;2:1;65.
点评 本题考查物质的量及溶液浓度有关计算,(1)中注意利用赋值法解答,简化计算过程,(2)中注意所含离子与化学式的关系,题目难度中等.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 低温高压 | B. | 低温低压 | C. | 高温高压 | D. | 使用合适催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
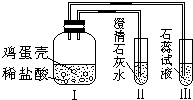 某同学做“证明鸡蛋壳的主要成分是碳酸盐”的实验时,设计了如图所示的方案.经检验装置气密性合格并加入试剂.下列说法中不正确的是( )
某同学做“证明鸡蛋壳的主要成分是碳酸盐”的实验时,设计了如图所示的方案.经检验装置气密性合格并加入试剂.下列说法中不正确的是( )| A. | 鸡蛋壳发生了分解反应 | |
| B. | Ⅰ中发生的现象为鸡蛋壳逐渐溶解,产生大量气泡 | |
| C. | II中的澄清石灰水变浑浊 | |
| D. | III中紫色石蕊试液变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12Q | B. | 10Q | C. | 8Q | D. | 6Q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12:7 | B. | 3:1 | C. | 1:3 | D. | 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com