
分析 (1)原子晶体的构成微粒为原子,分子晶体的构成微粒为分子,但稀有气体形成的分子晶体由原子构成的分子;
(2)离子晶体中一定含有离子键,在离子晶体中非金属元素之间形成共价键,分子晶体中只有一种元素组成的为单质;
(3)受热熔化化学键不发生变化的是分子晶体;原子晶体熔化需克服共价键.
解答 解:A.水晶(SiO2)中含共价键,为共价化合物,为原子晶体;
B.冰醋酸中含共价键,为共价化合物,为分子晶体;
C.氧化镁中含离子键,为离子化合物,为离子晶体;
D.白磷中含共价键,为单质,属于分子晶体;
E.晶体氩中不含化学键,为单质,属于分子晶体;
F.氯化铵中含离子键和共价键,为离子化合物,为离子晶体;
G.铝为金属单质,为金属晶体;
H.金刚石含共价键,为单质,属于原子晶体,
(1)属于原子晶体的化合物是水晶、金刚石,直接由原子构成的晶体是原子晶体和单原子分子形成的分子晶体,有水晶、晶体氩以及金刚石,稀有气体形成的分子晶体由原子构成的分子,即氩晶体是由原子构成的分子晶体,
故答案为:A;AH;E;
(2)由分子构成的晶体是分子晶体,有冰醋酸、白磷、晶体氩,氯化铵、过氧化钾含有离子键和共价键,属于分子晶体的单质是白磷和晶体氩,
故答案为:B;F;DE;
(3)在一定条件下能导电而不发生化学键断裂的是G,受热熔化后化学键不发生变化的化合物是BDE,受热熔化后需克服共价键的是AH,故答案为:G;BDE;AH.
点评 本题考查晶体类型的判断及晶体的性质,为高频考点,注意晶体的构成微粒、化学键、物质的分类即可解答,综合性较强,题目难度不大,(3)为解答的难点.


科目:高中化学 来源: 题型:选择题
| A. | 已知2C(s)+O2(g)=2CO(g)△H=-221 kJ•mol-1,则可知C的燃烧热为-110.5 kJ•mol-1 | |
| B. | 在101kPa下氢气的燃烧热△H=-285.8 kJ•mol-1,则水分解的热化学方程式:2 H2O (l)=2H2 (g)+O2 (g)△H=+285.8 kJ•mol-1 | |
| C. | Ba(OH)2(aq)+H2SO4(aq)=BaSO4(s)+2H2O(l)△H=-2akJ•mol-1,则任何强酸和强碱发生中和反应生成1molH2O(l)的反应热均为-akJ•mol-1 | |
| D. | 1g甲烷完全燃烧生成液态水的过程中放出55.6kJ热量,则CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
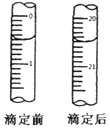 检测血液中的Ca2+能够帮助判断多种疾病.某研究小组测定血液样品中Ca2+的含量(l00mL血液中含Ca2+的质量),实验步骤如下:
检测血液中的Ca2+能够帮助判断多种疾病.某研究小组测定血液样品中Ca2+的含量(l00mL血液中含Ca2+的质量),实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H2S | B. | SO2 | C. | SO2、O2 | D. | SO2、H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
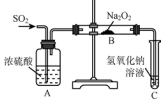 (1)已知Na2O2能与CO2反应,可用来呼吸面具中的做生氧剂.该反应:
(1)已知Na2O2能与CO2反应,可用来呼吸面具中的做生氧剂.该反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子从K2FeO4电极沿导线移向Zn电极 | |
| B. | 正极反应式为2FeO42-+10H++6e-=Fe2O3+5H2O | |
| C. | 该电池放电过程中电解质溶液浓度不变 | |
| D. | 电池工作时OH-向负极迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
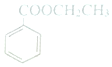
| A. | 分子式为C9H10O2 | |
| B. | 能发生取代、加成反应 | |
| C. | 苯环上的一氯代物有3种 | |
| D. | 在酸性条件下水解产物均能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三上10月月考化学试卷(解析版) 题型:选择题
某届奥运会上,有个别运动员因服用兴奋剂被取消参赛的资格。下图是检测出兴奋剂的某种同系物X的结构,关于X的说法正确的是( )

A.X分子中不可能所有原子都在同一平面上
B.X 遇到FeCl3溶液时显紫色,而且能使溴的四氯化碳溶液褪色
C.1 mol X 与足量的浓溴水反应,最多消耗5 mol Br2
D.1 mol X在一定条件下与足量的氢气反应,最多消耗1 mol H2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二上10月月考化学试卷(解析版) 题型:选择题
根据热化学方程式S(s)+O2(g)===SO2(g) ΔH=-297.23kJ·mol-1,分析下列说法中正确的是
①S(g)+O2(g)===SO2(g) ΔH=-Q,Q值大于297.23kJ·mol-1
②S(g)+O2(g)===SO2(g) ΔH=-Q,Q值小于297.23kJ·mol-1
③1molSO2的键能总和大于1molS与1molO2的键能总和
④1molSO2的键能总和小于1molS与1molO2的键能总和
A.①③ B.②④ C.①④ D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com