
分析 (1)依据已知热化学方程式构建目标方程式,根据盖斯定律计算得到目标方程式的反应热;
(2)亚硝酸钠具有氧化性,酸性条件下能氧化碘离子生成碘,另一产物是一种能与人体血红蛋白结合的气体为一氧化氮;该反应中N化合价变化为(+3→+2),I化合价变化为(-1→0),根据得失电子守恒书写方程式和计算反应中转移电子数;
(3)亚硝酸钠是强碱弱酸盐,亚硝酸根离子水解而使其溶液呈碱性,据此判断NaNO2溶液中各离子浓度大小;
(4)根据亚硝酸钠和氯化钠的不同性质来进行区分;
(5)用NO、NO的混合气体与NaOH溶液反应制备NaNO2,为N元素的价态归中反应,根据得失电子守恒和原子守恒书写;
(6)根据质量守恒定律和N2、NH3、NO2、SO2的物理性质判断.
解答 解:(1)已知①Na3N(s)$\frac{\underline{\;\;△\;\;}}{\;}$ 3Na(s)+$\frac{1}{2}$N2(g)△H1=akJ/mol;
②2Na(s)+3N2(g)=Na3N(s),△H2=bkJ/mol;
③N2(g)+3H2(g)=2NH3(g),△H3=ckJ/mol;
叠氮化钠(NaN3)与H2在催化剂作用下生成氮化钠(Na3N)和NH3(g)的化学方程式为:3NaN3(s)+12H2(g)=Na3N(s)+8NH3(g),
由③×4-$\frac{3}{2}$×②-①可得,所以叠氮化钠(NaN3)与H2在催化剂作用下生成氮化钠(Na3N)和NH3(g)的热化学方程式为:3NaN3(s)+12H2(g)=Na3N(s)+8NH3(g)△H=(4c-$\frac{3}{2}$b-a)kJ/mol,
故答案为:3NaN3(s)+12H2(g)=Na3N(s)+8NH3(g)△H=(4c-$\frac{3}{2}$b-a)kJ/mol;
(2)在酸性溶液中亚硝酸钠能与KI反应成单质碘和一种能与人体血红蛋白结合的气体为NO,根据得失电子守恒和原子守恒,该反应的离子方程式为:4H++2NO2-+2I-=I2+2NO↑+2H2O,该反应中N化合价变化为(+3→+2),I化合价变化为(-1→0),若生成的气体在标准状况下的体积为11.2L,即生成0.5molNO,转移的电子数为0.5mol,
故答案为:4H++2NO2-+2I-=I2+2NO↑+2H2O;0.5mol;
(3)亚硝酸钠是强碱弱酸盐,亚硝酸根离子水解:NO2-+H2O?HNO2+OH-,溶液呈碱性,则c(OH-)>c(H+),所以离子浓度大小关系是c(Na+)>c(NO2-)>c(OH-)>c(H+),
故答案为:NO2-+H2O?HNO2+OH-;c(Na+)>c(NO2-)>c(OH-)>c(H+);
(4)AgNO2是一种微液溶于水的盐,但能溶于浓醋酸的白色固体,分别取少量的两种盐于试管中,分别滴加AgNO3溶液,然后再加入醋酸,若得到白色沉淀,则被检测的为食盐,白色沉淀为氯化银,若没有沉淀产生,则被检测的为NaNO2,
故答案为:分别取少量的两种盐于试管中,分别滴加AgNO3溶液,然后再加入醋酸,若得到白色沉淀,则被检测的为食盐,若没有沉淀产生,则被检测的为NaNO2;
(5)利用NO、NO2的混合气体与NaOH溶液反应制备NaNO2,N元素的化合价的变化为升高(+2→+3)、降低(+4→+3),根据得失电子守恒和原子守恒,该反成的化学方程式为:NO2+NO+2NaOH═2NaNO2+H2O,
故答案为:NO2+NO+2NaOH═2NaNO2+H2O;
(6)A.N2是无色无味的气体,故A错误;
B.根据质量守恒定律,反应物中不能含氢元素,不会生成NH3,故B错误;
C.NO2是红棕色有刺激性气味的气体,故C正确;
D.根据质量守恒定律,反应物中不能含硫元素,不会生成SO2,故D错误;
故选C.
点评 本题考查热化学方程式的书写、以电解质的电离为载体考查了离子浓度大小的比较物质的判断等知识点,明确物质的性质是解本题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 化学键 | C=O | H-H | C=C | C-H | H-O |
| 键能/KJ mol | 803 | 436 | x | 414 | 464 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2AlCl3(熔融)$\frac{\underline{\;电解\;}}{\;}$2Al+3Cl2↑ | |
| B. | 电解CuCl2溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+4H++O2↑ | |
| C. | 硫酸氢铵溶液与足量烧碱稀溶液共热:NH4++H++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O | |
| D. | Cu和AgNO3溶液反应:Cu+Ag+═Cu2++Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 180 kJ | B. | 220 kJ | C. | 240 kJ | D. | 280 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
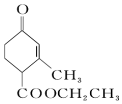 和
和  ,前者不含氧的官能团为(写结构简式)羰基、酯基,后者官能团有(写名称)酯基、羟基;
,前者不含氧的官能团为(写结构简式)羰基、酯基,后者官能团有(写名称)酯基、羟基;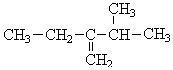 的名称为3-甲基-2-乙基-1-丁烯,
的名称为3-甲基-2-乙基-1-丁烯,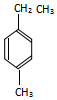 的名称为对甲基乙苯;
的名称为对甲基乙苯;
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用萃取的方法分离汽油和煤油 | |
| B. | 用NaOH溶液除去二氧化碳中的一氧化碳气体 | |
| C. | 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铁粉 | |
| D. | 要鉴别水中是否有氯离子,可加入AgNO3溶液,观察是否产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羟基的电子式: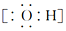 | B. | 乙酸的分子式:CH3COOH | ||
| C. | 溴乙烷的结构简式:CH2BrCH2Br | D. | 乙炔的实验式:CH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com