
| A. | 高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路” | |
| B. | 侯氏制碱法的工艺原理主要应用了物质熔沸点的差异 | |
| C. | 铝合金的大量使用归功于人们能使用焦炭等还原剂从氧化铝中获得铝 | |
| D. | 用蘸有浓氨水的玻璃棒检验输送氯气的管道是否漏气 |
分析 A光导纤维主要成分是二氧化硅;
B.利用碳酸氢钠的溶解度较小的原理;
C.根据金属的活泼性判断金属的冶炼方法;
D.NH3能与Cl2反应生成NH4Cl,该物质是一种白色固体物质.
解答 解;A.光导纤维主要成分是二氧化硅,能够与氢氧化钠反应被腐蚀而造成短路,故A错误;
B.侯氏制碱法的工艺过程中主要应用了物质的溶解度的差异,故B错误;
C.铝是活泼金属,所以要用电解氧化铝的方法冶炼,故C错误;
D.NH3是碱性气体,可以与Cl2反应生成NH4Cl,该物质是一种白色固体物质,可根据是否冒白烟用浓氨水检验输送氯气的管道是否有泄漏,故D正确;
故选:D.
点评 本题考查了元素化合物知识,明确物质的性质是解题关键,注意侯氏制碱法的原理、金属冶炼的方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 氧化剂与还原剂的物质的量之比为1:5 | |
| B. | 该过程说明KMnO4酸化时不能滴加盐酸 | |
| C. | 反应过程中转移2mol电子时,产生Cl2的体积约为22.4L | |
| D. | 若把该反应设计成原电池,则正极反应为MnO4-+5e-+8H+═Mn2++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
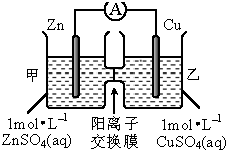
| A. | 锌电极上发生还原反应 | |
| B. | 电池工作一段时间后,甲池的c(SO42-)不变 | |
| C. | 电池工作一段时间后,甲池溶液的总质量增加 | |
| D. | 该装置将化学能转化为电能,一段时间后,装置内的电子总量减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ①②③④ | C. | ②③④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60 g SiO2晶体中含有Si-O键数目为2NA | |
| B. | 常温常压下,1.6 9 O2和O3的混合气体所含电子数为0.8NA | |
| C. | 1 mol/L AICl3溶液中,所含Al3+数目小于NA | |
| D. | 密闭容器中2 mol NO与l mol 02充分反应,产物的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 讨论 | B. | 调查 | C. | 观察和实验 | D. | 上网 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 根据图1可知合成甲醇的热化学方程式为CO(g)+2H2(g)═CH3OH(g)△H1=(b-a)kJ•mol-1 | |
| B. | 图2表示2 mol H2(g)所具有的能量比2 mol气态水所具有的能量多483.6 kJ | |
| C. | 1 mol NaOH分别和1 mol 稀硫酸、1 mol浓硫酸反应,前者的△H比后者的△H大 | |
| D. | 汽油燃烧时将全部的化学能转化为热能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com