
【题目】下列叙述正确的是
A.次氯酸的电离方程式为:HClO = H+ + ClO-
B.c(H+)等于1×10-7mol·L-1的溶液一定是中性溶液
C.在CH3COONa溶液中,c(CH3COO-) < c(Na+)
D.0.2 mol·L-1 CH3COOH溶液中的c(H+)是0.1 mol·L-1 HCl溶液中的c(H+)的2倍
科目:高中化学 来源: 题型:
【题目】反应![]() 在一个密闭容器中进行,下列措施可以使反应速率增大的是( )
在一个密闭容器中进行,下列措施可以使反应速率增大的是( )
①增加少量![]() ②升高温度③体积不变,再通入
②升高温度③体积不变,再通入![]() ④缩小体积增大压强⑤体积不变,再通入He⑥压强不变,再通入He
④缩小体积增大压强⑤体积不变,再通入He⑥压强不变,再通入He
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一小段镁带,用砂纸除去表面的氧化膜,放入试管中。向试管中加入2mL水,并滴入2滴酚酞试液。一会儿后发现镁带表面有气泡放出,且镁带附近溶液变红色。加热试管至水沸腾。发现镁带表面有大量气泡放出,且试管中的液体全部变为浅红色。关于该实验下列说法不正确的是
A. 温度越高,镁与水反应的速率越快
B. 镁与水反应的化学方程式为:Mg+2H2O = Mg(OH)2+H2↑
C. 氢氧化镁显碱性,且在水中有一定的溶解性
D. 氢氧化镁是离子化合物,它的电子式可表示为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列反应不可能自发进行的是
A.2O3(g)=3O2(g) △H<0
B.CaCO3(s)=CaO(s)+CO2(g) △H>0
C.N2(g)+3H2(g) ![]() 2NH3(g) △H<0
2NH3(g) △H<0
D.2CO(g)=2C(s)+O2(g) △H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下的化学反应CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度的关系如下表,根据信息推断以下说法正确的是
CO(g)+H2O(g),其化学平衡常数K和温度的关系如下表,根据信息推断以下说法正确的是
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
A.此反应为放热反应
B.此反应只有达到平衡时,密闭容器中的压强才不会变化
C.830℃时,反应物CO2与H2按1:1投料,平衡时H2的转化率为50%
D.该反应的化学平衡常数越大,反应物的转化率越低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液存在H2CO3/HCO3-、HPO42-/H2PO4-等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值lg x[x表示c(H2CO3)/c(HCO3-)或c(HPO42-)/c(H2PO4-)]与pH的关系如图所示。已知碳酸pKal=6.4、磷酸pKa2=7.2(pKa= -lgKa)。则下列说法正确的是

A. 曲线I表示lg c(HPO42-)/c(H2PO4-)与pH的变化关系
B. a-b的过程中,水的电离程度逐渐减小
C. 当c(H2CO3)=c(HCO3-)时,c(HPO42-)=c(H2PO4-)
D. 当pH增大时,c(HCO3-)c(H2PO4-)/c(HPO42-)逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 lmol碳完全燃烧后可放出393.5KJ的热量,下列热化学方程式正确的是( )
A.C(s)+O2(g)=CO2(g) △H=+393.5kJ/mol
B.C(s)+![]() O2(g)=CO(g) △H=﹣393.5kJ/mol
O2(g)=CO(g) △H=﹣393.5kJ/mol
C.C+O2=CO2 △H=﹣393.5kJ/mol
D.C(s)+O2(g)=CO2(g) △H=﹣393.5kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)肼(N2H4)又称联氨,在常温下是一种可燃性的液体,可用作火箭燃料。已知在101 kPa时,1 g N2H4在氧气中完全燃烧生成氮气和H2O(l),放出19.5 kJ热量(25 ℃时),表示N2H4燃烧的热化学方程式是____________________________ 。
(2)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4 mol液态肼和足量液态H2O2反应,生成氮气和液态水,放出327.05 kJ的热量。写出该反应的热化学方程式:__________________________________。
(3)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为_________________________________________________。
(4)下图是一定量丙烷完全燃烧生成CO2 和1mol H2O (l)过程中的能量变化图。
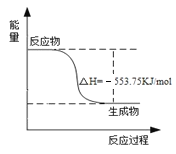
写出表示丙烷燃烧热的热化学方程式:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列问题。
(1)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓(GaAs)、硫化镉(CdS)薄膜电池等.
①As的基态原子的电子排布式[Ar]_______________.
②第一电离能:As___Ga(填“>”、“<”或“=”).
(2)配合物Fe(CO)5常温下呈液态,熔点为-20.5 ℃,易溶于 CCl4 中,则Fe(CO)5是______分子(非极性或极性)。
(3)BF3常温下是气体,有强烈的接受孤电子对的倾向。BF3与NH3相遇,立即生成白色固体。BF3的杂化轨道类型为:____ ;写出该白色固体的结构式,并标注出其中的配位键___________。
(4)下列有关说法不正确的是____。
A.沸点:NH3 >PH3,CH3OH > HCHO
B.SO2与CO2的化学性质有些类似,但空间结构与杂化方式不同
C.熔、沸点: SiF4< SiCl4< SiBr4 <SiI4 , 原因是分子中共价键键能逐渐增大
D.熔点: CaO > KCl > KBr,原因是晶格能逐渐减小

(5)钠钾合金属于金属晶体,某种合金的晶胞结构如图所示,晶体中K 原子的配位数为______;已知金属原子半径r(Na)、r(K),计算晶体的空间利用率 __________(假设原子是刚性球体)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com