
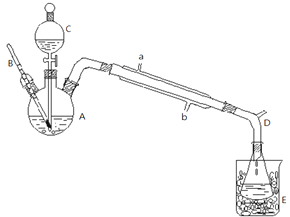
| 140℃ |
| 名称 | 相分子质量 | 密度 g/mL | 熔点 ℃ | 沸点 ℃ | 溶解度:g/100mL溶剂 | ||
| 水 | 醇 | 醚 | |||||
| 浓H2SO4 | 98.00 | 1.84 | 10.35 | 340 | |||
| 乙醚 | 74.00 | 0.71 | -89.12 | 34.5 | 能溶 | 混溶 | 混溶 |
| 乙醇 | 46.00 | 0.780 | -114.5 | 78.4 | ∞ | ∞ | ∞ |
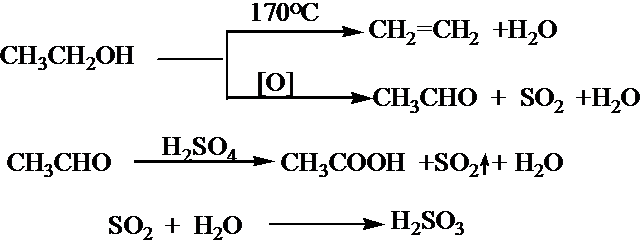
| 74 |
| 92 |
| 8g | ||
|
| 8g | ||
|


科目:高中化学 来源: 题型:
| A、增大FeO(s)表面积 |
| B、增大体系压强 |
| C、升高体系温度 |
| D、使用适合的催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
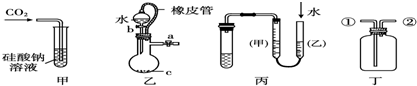
| A、甲装置:可用来证明碳酸的酸性比硅酸强 |
| B、乙装置:c为二氧化硅可制硅酸 |
| C、丙装置:可进行氢氟酸与二氧化硅的反应并测定气体体积 |
| D、丁装置:从②口进气可用于收集二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:
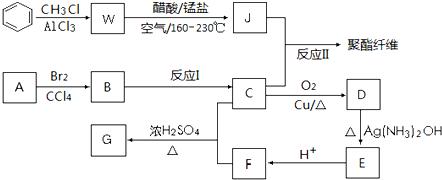
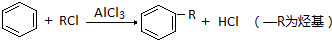

查看答案和解析>>
科目:高中化学 来源: 题型:
| 检测次数 | 溶液中检测出的物质 |
| 第一次 | MgSO4、NaNO3、KNO3、 |
| 第二次 | Mg (NO3)2、KNO3、Na2SO4 |
| 第三次 | Mg (NO3)2、Ba(NO3)2、Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2mol C |
| B、2molA、1molB和1molHe(不参加反应) |
| C、1molB和1molC |
| D、2molA、3molB和3molC |
查看答案和解析>>
科目:高中化学 来源: 题型:


 )的合成路线(不超过四步)(合成路线常用的表示方式为:A
)的合成路线(不超过四步)(合成路线常用的表示方式为:A| 反应试剂 |
| 反应条件 |
| 反应试剂 |
| 反应条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 电解原理在化学工业中有广泛应用,如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用,如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、②④ |
| C、①③④ | D、①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com