
下列各组中两种气体所含的原子数一定相等的是:
 A.温度相同,体积相同的O2和N2
A.温度相同,体积相同的O2和N2
B.质量相等,密度不等的N2和CO
 C.体积相等,密度相等的CO和C2H4
C.体积相等,密度相等的CO和C2H4
D.压强相同、体积相同的N2和O2
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列说法中正确的是 ( )
A.铁是人类在生产、生活中最早使用的金属材料
B.金、银、铜是应用最广泛的金属材料
C.钛被誉为“21世纪的金属”,应用前景很广阔
D.铜是导电性、导热性最好的有色金属
查看答案和解析>>
科目:高中化学 来源: 题型:
最近雾霾天气又开始肆虐我国大部分地区。其中SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2。
(1)钠碱循环法中,吸收液为Na2SO3溶液,该吸收反应的离子方程式是________________。
(2)已知H2SO3的电离常数为K1=1.54×10-2,K2=1.02×10-7,H2CO3的电离常数为K1=4.30×10-7,K2=5.60×10-11,则下列微粒可以共存的是 ________________。
A.CO HSO
HSO B.HCO
B.HCO HSO
HSO
C.SO HCO
HCO D.H2SO3 HCO
D.H2SO3 HCO
(3)吸收液吸收SO2的过程中,pH随n(SO ):n(HSO
):n(HSO )变化关系如下表:
)变化关系如下表:
| n(SO | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显________________性,从原理的角度解释原因________________。
②在NaHSO3溶液中微粒浓度关系不正确的是________(选填字母)。
A.c(Na+)=2c(SO )+c(HSO
)+c(HSO )
)
B.c(Na+)>c(HSO )>c(H+)>c(SO
)>c(H+)>c(SO )>c(OH-)
)>c(OH-)
C.c(H2SO3)+c(H+)=c(SO )+c(OH-)
)+c(OH-)
D.c(Na+)+c(H+)=2c(SO )+c(HSO
)+c(HSO )+c(OH-)
)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
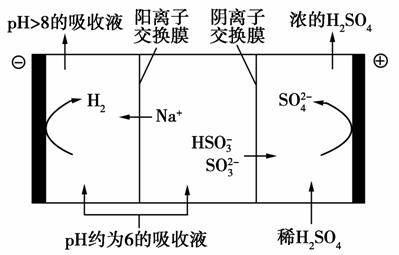
①吸收液再生过程中的总反应方程式是________________。
②当电极上有1 mol电子转移时阴极产物为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
把Ba(OH)2溶液滴入明矾溶液中,使SO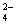 全部转化成BaSO4沉淀,此时铝元素
全部转化成BaSO4沉淀,此时铝元素
的主要存在形式是
 A.Al3+ B.Al(OH)3 C.AlO2— D.Al3+ 和Al(OH)3
A.Al3+ B.Al(OH)3 C.AlO2— D.Al3+ 和Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各反应中电子转移方向和数目表示正确的是:
 得6e—
得6e—
A.
 KClO3 + 6 HCl = KCl + 3 Cl2 + 3H2O
KClO3 + 6 HCl = KCl + 3 Cl2 + 3H2O
失6e—
失2e—
 B.
B.
2Na2O2 + 2 CO2 = 2Na2CO3 + O2

得2e—
2 e—

C. 2 Na + 2 H2O = 2 NaOH + H2
失2e— 失4e—
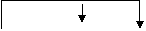 |
D. 2Al + 2 NaOH + 2 H2O = 2 NaAlO2 +3H2
查看答案和解析>>
科目:高中化学 来源: 题型:
某一无色透明溶液中只可能存在H+、Ba2+、Mg2+、Cu2+、OH-、HCO3-、
CO32-、NO3-、SO42- 中的一种或几种。已知该溶液能与Al反应放出H2
(1)若反应生成Al3+,则原溶液中一定存在 可能存在的离子有
(2)若反应生成AlO2- ,则原溶液中一定存在 可能存在的离子有
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学反应中,既有离子键、极性键、非极性键的断裂,又有离子键、极性键、非极性键形成的是
A. 2Na2O2 + 2H2O == 4NaOH + O2↑ B. Mg3N2 + 6H2O == 3Mg(OH)2 + 2NH3↑
C. Cl2 + H2O == HCl + HClO D. NH4Cl + NaOH== NaCl+ NH3↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料——光导纤维,C与烧碱反应生成含A元素的化合物D。
(1)在元素周期表中,A位于________族,与A同族但相对原子质量比A小的元素B的原子结构示意图为________,A与B在原子的电子层结构上的相同点是________________________________________________________________________
________________________________________________________________________。
(2)易与C发生化学反应的酸是________(写名称),反应的化学方程式是________________________________________________________________________。
(3)将C与纯碱混合高温熔融时也发生化学反应生成D,同时还生成B的最高价氧化物E;将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物F。
①写出生成D和F的化学反应方程式:_____________________________________
________________________________________________________________________。
②要将纯碱高温熔化,下列坩埚中可选用的是________。
A.普通玻璃坩埚 B.石英玻璃坩埚
C.氧化铝坩埚 D.铁坩埚
(4)100 g C与石灰石的混合物充分反应后,生成的气体在标准状况下的体积为11.2 L,
100 g混合物中石灰石的质量分数是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com