
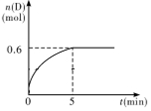
分析 (1)0~5min内,v(D)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.6-0}{1}}{5}$mol/(L.min)=0.12mol/(L.min),v(B)=2v(D);
(2)开始时c(A)=1.0mol/L、c(B)=2.2mol/L,平衡时c(D)=0.6mol/L,
该反应中A(g)+2B(g)?C(g)+D(g),
开始(mol/L)1.0 2.2 0 0
反应(mol/L)0.6 1.2 0.6 0.6
平衡(mol/L)0.4 1.0 0.6 0.6
化学平衡常数K=$\frac{c(C).c(D)}{c(A).{c}^{2}(B)}$;
(3)若700℃,反应达平衡时,A的浓度为0.55mol/L>0.4mol/L,说明降低温度平衡逆向移动;
(4)先计算浓度商,根据浓度商与化学平衡常数相对大小确定反应方向.
解答 解:(1)0~5min内,v(D)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.6-0}{1}}{5}$mol/(L.min)=0.12mol/(L.min),v(B)=2v(D)=2×0.12mol/(L.min)=0.24mol/(L.min),
故答案为:0.24mol/(L.min);
(2)开始时c(A)=1.0mol/L、c(B)=2.2mol/L,平衡时c(D)=0.6mol/L,
该反应中A(g)+2B(g)?C(g)+D(g),
开始(mol/L)1.0 2.2 0 0
反应(mol/L)0.6 1.2 0.6 0.6
平衡(mol/L)0.4 1.0 0.6 0.6
化学平衡常数K=$\frac{c(C).c(D)}{c(A).{c}^{2}(B)}$=$\frac{0.6×0.6}{0.4×1.{0}^{2}}$=0.9,
故答案为:0.9;
(3)若700℃,反应达平衡时,A的浓度为0.55mol/L>0.4mol/L,说明降低温度平衡逆向移动,则正反应是吸热反应,故答案为:吸热;
(4)浓度商=$\frac{0.20×0.018}{0.06×0.5{0}^{2}}$=0.24<0.9,浓度商小于平衡常数,平衡向正方向进行,
故答案为:向正方向进行.
点评 本题考查化学平衡计算,为高频考点,侧重考查学生分析计算能力,明确化学平衡常数与温度关系、化学平衡常数计算方法是解本题关键,注意化学平衡常数的灵活运用,题目难度不大.


科目:高中化学 来源: 题型:选择题
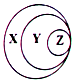
| A. | X-胶体 Y-混合物 Z-淀粉溶液 | B. | X-化合物 Y-含氧酸盐 Z-氯化钠 | ||
| C. | X-气态氢化物 Y-酸 Z-盐酸 | D. | X-强电解质 Y-强酸 Z-硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,反应类型为
,反应类型为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=3和pH=5的盐酸各10mL混合,所得溶液的pH=4 | |
| B. | 当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数 | |
| C. | 液氯虽然不导电,但溶解于水后导电情况良好,因此,液氯也是强电解质 | |
| D. | 溶液中c(H+)越大,pH也越大,溶液的酸性就越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
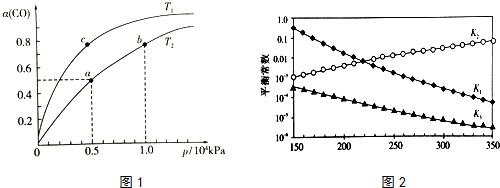
 在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应H2(g)+Br2(g)?2HBr(g)△H<0.当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法正确的是( )
在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应H2(g)+Br2(g)?2HBr(g)△H<0.当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法正确的是( )| A. | 若b、c两点的平衡常数分别为K1、K2,则K1>K2 | |
| B. | a、b两点的反应速率:b>a | |
| C. | 为了提高Br2(g)的转化率可采取增加Br2(g)通入量的方法 | |
| D. | b、c两点的HBr的体积分数b>c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(KJ•mol-1) | 436 | 343 | x | 465 | 413 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
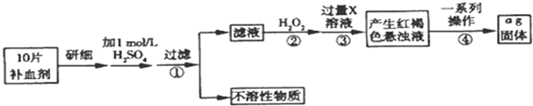
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验内容 | 实验目的 | |
| A | 向某未知溶液中加人BaCl2溶液后,再加人稀硝酸观察沉淀的生成 | 检验是否含 SO42-离子 |
| B | 向某未知溶液中加人NaOH固体,加热,在管口用湿润的蓝色石蕊试纸检验 | 检验是否含NH4+离子 |
| C | 加热分别用SO2和HClO漂白后的品红溶液 | 探究SO2和HCIO漂白原理的不同 |
| D | 加热盛有浓硫酸和铜的试管 | 探究浓硫酸的脱水性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com