
【题目】下列物质中既含有离子键又含有共价键的是( )
A. NaOH、H2O、NH4Cl B. KOH、Na2O2、(NH4)2S
C. H2O2 、MgO、Na2SO4 D. CaBr2 、HCl、 MgCl2
科目:高中化学 来源: 题型:
【题目】下列判断中一定正确的是( )
A. NaCl及Na2O2固体中阴、阳离子数之比均为1:1
B. 等质量的O2与O3中,氧原子的个数比为3:2
C. 分别用H2O2、KMnO4分解制O2,当制得等质量O2时,转移电子数之比为1:2
D. 10 mL 0.3 mol·L-1 NaCl溶液与30 mL 0.1 mol·L-1 AlCl3溶液中Cl -物质的量浓度比为1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
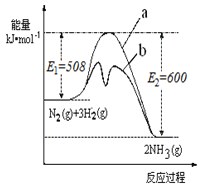
(1)根据如图提供的信息,写出该反应的热化学方程式 ,下图的曲线中 (填“a” 或“b”)表示加入铁触媒(催化剂)的能量变化曲线。
(2)在恒容容器中,下列描述中能说明上述反应已达
平衡的是 。
A.3υ(H2)正=2υ(NH3)逆
B.单位时间内生成n mol N2的同时生成2n molNH3
C.容器内气体的密度不随时间的变化而变化
D.容器内压强不随时间的变化而变化
(3)为了寻找合成NH3的适宜条件,某同学设计了三组实验(如下表),请在下表空格处填入相应的实验条件及数据。
实验编号 | T(℃) | n (N2)/n(H2) | P(MPa) |
ⅰ | 450 | 1/3 | 1 |
ⅱ | 1/3 | 10 | |
ⅲ | 480 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备氨基甲酸铵(NH2COONH4)的反应如下:2NH3(g)+CO2(g)![]() NH2COONH4(s)该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢氨。
NH2COONH4(s)该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢氨。
(1)该反应在一定条件下能够白发进行,则反应的△H_____________0(填“>”、“<”或“一”)。
(2)写出生成碳酸氢氨的化学方程式:______________。
(3)实验步骤如下:
步骤1:按图所示组装仪器,检查装置的气密性。

步骤2:在相应仪器中装入药品,其中在三颈烧瓶中加入氢氧化钠固体,恒压滴液漏斗中装入浓氨水。
步骤3:滴加浓氨水并搅拌,调节反应速率,在反应器中得到产品。
干燥管中盛放的药品是___________。
对比碳酸盐和酸反应制CO2,该实验利用干冰升华产生CO2气体的优点是__________________。
③以恒压滴液漏斗代替分液漏斗的目的是______________________。
(4)该实验装置可能存在的安全问题是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z三种主族元素在元素周期表中的位置如图所示。设X的原子序数为a,则下列说法不正确的是

A. Y的原子序数可能为a-17
B. Y与Z的原子序数之和可能为2a
C. Z的原子序数可能为a+31
D. X、Y、Z一定为短周期元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe(OH)3可用来制颜料、药物,作净水剂。现设计实验研究制备Fe(OH)3的方法。
资料:新制Fe(OH)3在溶液中存在两种电离:Fe3++3OH-![]() Fe(OH)3
Fe(OH)3![]() H++FeO2-+H2O
H++FeO2-+H2O
(1)向3支盛有1 mL 1.0 mol·L-1 FeCl3溶液的试管中,分别加入3 mL不同浓度的NaOH溶液,都产生红褐色沉淀。充分反应后,过滤,取滤液分成两等份,分别进行实验,实验记录如下:
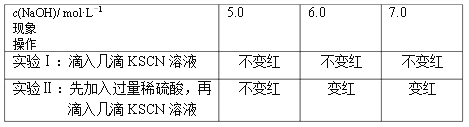
① 产生红褐色沉淀的离子方程式是________。
② 当c(NaOH)≥6.0 mol·L-1时,实验Ⅱ中溶液变红的原因是________、________(用离子方程式表示)。
(2)有同学提出可用某些盐与FeCl3反应制备Fe(OH)3。
① 向1 mL 1.0 mol·L-1 FeCl3溶液中滴加1.0 mol·L-1 Na2CO3溶液,立即有大量气泡并有红褐色沉淀产生。有同学提出沉淀中可能含有碳酸盐。将沉淀过滤、洗涤后取样,________,证明沉淀中含有碳酸盐。
② 向1 mL 1.0 mol·L-1 FeCl3溶液中滴加1.0 mol·L-1 Na2SO3溶液,溶液由黄色变为红色,无丁达尔效应,继续滴加Na2SO3溶液,最终得到红褐色沉淀。经检验沉淀中除Fe(OH)3外还含有FeSO3。产生FeSO3的原因是_________________。
(3)比较(1)和(2),制备Fe(OH)3的合理方法是___________(注明试剂和用量)。
(4)FeSO4溶液仅与一种试剂反应也可制Fe(OH)3,该试剂的化学式是________(写出一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全世界每年被腐蚀损耗的钢铁材料约占全年钢铁产量的十分之一。研究钢铁的腐蚀及防护有重要意义。回答下列问题:
(1)钢铁发生腐蚀的主要类型是电化学腐蚀,在电化学腐蚀中,负极反应是_____________,正极反应是_____________。
(2)某实验小组设计下列实验探究铁生锈的条件:
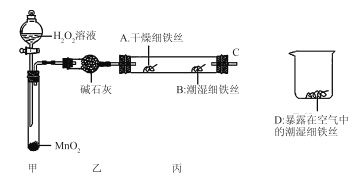
反应4 min后观察,发现A处铁丝依然光亮,B处铁丝表面灰暗,D处铁丝依然光亮。该实验说明铁生锈主要与_________和___________有关;B、D处实验现象对比说明:决定铁生锈的一个重要因素是___________。
(3)金属及塑料制品表面镀铬不仅美观还可提高金属制品抗腐蚀性能。常见镀铬液由重铬酸(H2Cr2O7)和催化剂硫酸组成。
①重铬酸中,Cr元素的化合价为________。
②镀铬时由CrO42-放电产生铬镀层。阴极的电极反应式为_______。
(4)电镀废水中Cr2O72-具有高毒性,必须经处理后才能排放。电解法处理含铬的强酸性废水的原理如右图所示。
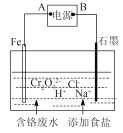
电解产生的Fe2+将Cr2O72-还原为Cr3+,再随着溶液pH的升高,便有Fe(OH)3和Cr(OH)3沉淀生成。
①图中A为电源__________极;电解时阴极产生的气体为____________(写化学式)。
②写出Fe2+与Cr2O72-反应的离子方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B两个完全相同的装置,某学生分别在它们的侧管中装入一定量的Na2CO3和NaHCO3,A、B中分别装有足量的盐酸,将两个侧管中的物质同时倒入各自的试管中,下列叙述正确的是
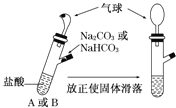
A. 侧管中装入Na2CO3的气球膨胀速率大
B. 若加入等质量的Na2CO3和NaHCO3 ,最终两气球体积不同
C. 最终两试管中Na+、Cl-的物质的量一定相同
D. 热稳定性:Na2CO3 < NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图a、b、c、d均为铂电极,供选择的电解质溶液如下表( )
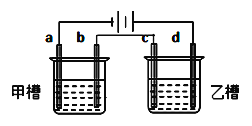
要满足的条件是:①工作一段时间后,甲槽电解液pH上升,而乙槽电解液pH下降;
②b、c两极放电离子的物质的量相等。则应选用的电解液是
组 | A | B | C | D |
甲槽 | NaOH | Cu(NO3)2 | KCl | Na2SO4 |
乙槽 | CuSO4 | NaCl | AgNO3 | NaNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com