
| A、实验室常用饱和NaHCO3溶液除去CO2中混有的SO2气体 |
| B、打开雪碧的瓶盖,立即有气体逸出 |
| C、经粉碎的黄铁矿在沸腾炉中燃烧得较快、较完全 |
| D、合成氨工厂通常采用20MPa~50MPa压强,以提高原料的利用率 |


科目:高中化学 来源: 题型:

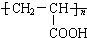 的单体,则A中所含官能团的名称是
的单体,则A中所含官能团的名称是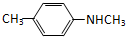 、
、查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
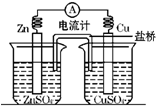
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将水加热到120℃,pH=6:c(OH-)<c(H+) |
| B、醋酸与醋酸钠的pH=7的混合溶液中:c(CH3COO-)>c(Na+) |
| C、0.lmoI?L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+) |
| D、pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐.现将一定量的铜片加入到100mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解.
金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐.现将一定量的铜片加入到100mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com