
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
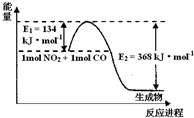 I.描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb).
I.描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb).| 酸或碱 | 电离平衡常数(Ka或 Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3?H2O | 1.8×10-5 |
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸或碱 | 电离平衡常数(Ka或Kb) |
| CH3COOH | 1.8×10-3 |
| HNO3 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3?H2O | 1.8×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
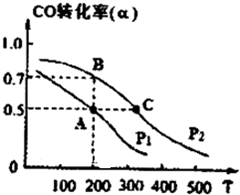 (2013?淄博一模)请运用化学反应原理的相关知识研究元素及其化合物的性质.
(2013?淄博一模)请运用化学反应原理的相关知识研究元素及其化合物的性质.| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 HCl+HClO,CaCO3与氯水中的HCl反应,使c(H+)减小,平衡向右移动,HClO浓度增大,故漂白性增强
HCl+HClO,CaCO3与氯水中的HCl反应,使c(H+)减小,平衡向右移动,HClO浓度增大,故漂白性增强 HCl+HClO,CaCO3与氯水中的HCl反应,使c(H+)减小,平衡向右移动,HClO浓度增大,故漂白性增强
HCl+HClO,CaCO3与氯水中的HCl反应,使c(H+)减小,平衡向右移动,HClO浓度增大,故漂白性增强| 催化剂 |
| △ |
| 催化剂 |
| △ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com