
| ||
| A、反应属于分解反应 |
| B、上述反应瞬间产生大量高温气体推动航天飞机飞行 |
| C、反应从能量变化上说,主要是化学能转变为热能和动能 |
| D、在反应中高氯酸铵只起氧化剂作用 |
| ||
| ||
| ||


 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
| 元素 | 结构特点及元素、单质、化合物的性质 |
| X | 气态氢化物与最高价氧化物对应水化物可以化合成盐 |
| Y | 原子中s电子数与p电子数相同,且p电子的能量最高 |
| Z | 单质在空气中燃烧产生黄色火焰,生成黄色粉末 |
| W | 最外层电子排布(n+1)sn(n+1)pn-1 |
| T | 单质升华可以产生紫色的烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3 |
| B、淀粉、纤维素、蛋白质和油脂都属于高分子化合物,一定条件下都能水解 |
| C、只用水就能鉴别苯、乙醇和四氯化碳 |
| D、分子式C4H8Cl2的有机物,分子中含2个甲基的同分异构体有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2具有还原性,故可作漂白剂 |
| B、Na的金属活动性比Mg强,故可用Na与MgCl2溶液反应制Mg |
| C、氨是氮肥工业、有机合成工业及制造硝酸、铵盐和纯碱的原料 |
| D、Fe在Cl2中燃烧生成FeCl3,故在与其它非金属反应的产物中的Fe也显+3价 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、ⅠA族元素的金属性比ⅡA族元素的金属性强 |
| B、第三周期元素的离子半径从左到右逐渐减小 |
| C、同周期非金属氧化物对应的水化物的酸性从左到右依次增强 |
| D、ⅥA族元素的氢化物中,稳定性最好的其沸点也最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

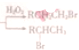 (R:烃基或氧原子,R′:烃基)
(R:烃基或氧原子,R′:烃基)
| OH- |
| -H2O |
 写出以丙烯和
写出以丙烯和 为原料制备A物质的合成路线图(无机试剂任选),合成路线流程图如下:CH2=CH2
为原料制备A物质的合成路线图(无机试剂任选),合成路线流程图如下:CH2=CH2| O2 |
| 催化剂 |
| O2 |
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 | 0.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com