
【题目】A、B、C、D、E、F为元素周期表中前四周期元素,且原子序数依次增大,A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C的氧化物是导致酸雨的主要物质之一,D原子核外电子有8种不同的运动状态,E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其他能层均已充满电子。
(1)写出基态E原子的价电子排布式_______。
(2)A与C可形成CA3分子,该分子中C原子的杂化类型为______,该分子的立体结构为_____;C的单质与BD化合物是等电子体,据等电子体的原理,写出BD化合物的电子式______;A2D由液态形成晶体时密度减小,其主要原因是__________(用文字叙述)。
(3)已知D、F能形成一种化合物,其晶胞的结构如图所示,则该化合物的化学式为___;若相邻D原子和F原子间的距离为a cm,阿伏加德罗常数的值为![]() NA,则该晶体的密度为______g·cm-3(用含a、NA的式子表示)。
NA,则该晶体的密度为______g·cm-3(用含a、NA的式子表示)。

【答案】3d54s1 sp3杂化 三角锥形 :CO: 水形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度减小 Cu2O 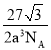
【解析】
B的一种核素在考古时常用来鉴定一些文物的年代,则B为C元素;
D原子核外电子有8种不同的运动状态,则D原子核外有8个电子,则D为O元素;
C的氧化物是导致酸雨的主要物质之一,且C的原子序数比O小,则C为N元素;
E的基态原子在前四周期元素的基态原子中单电子数最多,则E的基态原子核外电子排布式为:1s22s22p63s23p63d54s1,则E为24号元素Cr;
F位于前四周期、原子序数比E大且其基态原子最外能层只有一个电子,其他能层均已充满电子,则F的基态原子核外电子排布式为:1s22s22p63s23p63d104s1,则F为29号元素Cu;
A与其余五种元素既不同周期也不同主族,且能与C形成CA3分子,则A为H;
综上所述,A、B、C、D、E、F分别为:H、C、N、O、Cr、Cu,据此解答。
(1)E为Cr,其基态原子核外电子排布式为:1s22s22p63s23p63d54s1,则其价电子排布式为:3d54s1,故答案为:3d54s1;
(2)A为H,C为N,NH3分子中,中心N原子的σ键数=3,孤电子对数=![]() =1,则价层电子对数=3+1=4,则中心N原子的杂化类型为sp3杂化,有一对孤电子,则其空间构型为三角锥形。N2的电子式为:NN:,CO和N2互为等电子体,则CO的电子式为:CO:。水形成晶体(冰)时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率降低,导致密度减小,故答案为:sp3杂化;三角锥形;:CO:;水形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度减小;
=1,则价层电子对数=3+1=4,则中心N原子的杂化类型为sp3杂化,有一对孤电子,则其空间构型为三角锥形。N2的电子式为:NN:,CO和N2互为等电子体,则CO的电子式为:CO:。水形成晶体(冰)时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率降低,导致密度减小,故答案为:sp3杂化;三角锥形;:CO:;水形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度减小;
(3)D原子即O原子,F原子即Cu原子,由均摊法可知,1个晶胞中O原子个数=![]() =2,Cu原子个数=4,该化合物中Cu原子和O原子个数比=4:2=2:1,则该化合物的化学式为Cu2O,那么,1个晶胞的质量=
=2,Cu原子个数=4,该化合物中Cu原子和O原子个数比=4:2=2:1,则该化合物的化学式为Cu2O,那么,1个晶胞的质量=![]() 。设晶胞常数为b,Cu原子和O原子之间的距离为a cm,则体对角线=4a cm,则
。设晶胞常数为b,Cu原子和O原子之间的距离为a cm,则体对角线=4a cm,则![]() =4a,可得:b=
=4a,可得:b=![]() cm,所以,1个晶胞的体积=b3=(
cm,所以,1个晶胞的体积=b3=(![]() )3cm3,该晶体的密度=
)3cm3,该晶体的密度=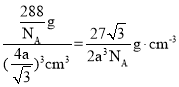 ,故答案为:Cu2O;
,故答案为:Cu2O;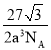 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】根据地球化学分析,地壳中存在量较大的9种元素含量如图所示,含量第一、第三、第四的三种元素用字母代号表示。回答下列问题:
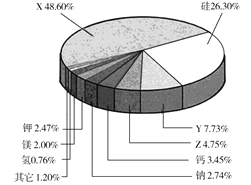
(1)X的名称为 _________,Z的元素符号为 _______ 。
(2)硅的氧化物与氢氟酸反应的化学方程为________,Y元素的单质与Z3X4反应的化学方程式为 ___________,23.2 g Z3X4完全反应时,转移的电子数目为__________。(用NA代表阿伏加德罗常数的值)
(3)NOx的消除。汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生如下反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) ΔH。
N2(g)+2CO2(g) ΔH。
已知:CO燃烧热的ΔH1=-283.0kJ·mol-1,N2(g)+O2(g) ![]() 2NO(g) ΔH2=+180.5kJ·mol-1,则ΔH=___________。
2NO(g) ΔH2=+180.5kJ·mol-1,则ΔH=___________。
(4)以MnSO4溶液为原料可通过电解法制备超级电容材料MnO2,其装置如图所示:
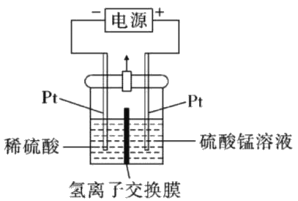
①则电解过程中阳极电极反应为_________。
②电解一段时间后,阴极溶液中H+的物质的量____________(填“变大”、“减小”或者“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质有如下转化关系,E为淡黄色粉末,通常用在呼吸面具中作为氧气的来源。

(1)A、C、E、F的化学式:
A______,C______,E______,F______。
(2)向饱和的C的溶液中通入足量CO2,会出现的现象是_____,有关反应的化学方程式为____。
(3)鉴别C与F溶液应选用的试剂是_____,有关反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL混合液中,HNO3和H2SO4的物质的量浓度分别为0.1mol/L和0.4mol/L。向该混合液中加入1.92g铜粉,加热使反应发生完全。下列说法正确的是(忽略反应前后溶液体积变化)( )
A.所得溶液中c(Cu2+)=0.225mol/L
B.所得溶液中c(H+)=0.5mol/L
C.所得气体在标准状况下的体积为0.448L
D.反应中转移0.06mol的电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇,
(催化剂为Cu2O/ZnO):CO(g)+2H2(g)![]() CH3OH(g),甲醇的物质的量与温度的关系如下图所示,下列分析正确的是 ( )
CH3OH(g),甲醇的物质的量与温度的关系如下图所示,下列分析正确的是 ( )
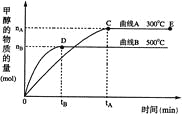
A. 反应达到平衡时,平衡常数表达式 K=c(CH3OH)/c(CO)·c2(H2)
B. 升高温度,K值增大
C. 在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=3tB/2nBmol·(L·min)-1
D. 其他条件不变,E点的体积压缩到原来的1/2,重新平衡时n(H2)/n(CH3OH)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,将1.0L c mol·L-1 CH3COOH溶液与0.1mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量的变化如图所示。下列叙述错误的是( )
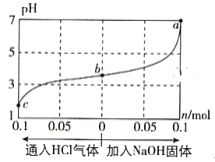
A. 水的电离程度:a>b>c
B. c点对应的混合溶液中:c(CH3COOH)>c(Na+)>c(OH-)
C. a点对应的混合溶液中:c(Na+)=c(CH3COO-)
D. 该温度下,CH3COOH的电离平衡常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.银氨溶液的配制:在洁净的试管中加入2%AgNO3溶液1~2mL,逐滴加入2%稀氨水,边滴边振荡,至沉淀恰好溶解时为止
B.丙醛在催化剂存在下与氢气反应是还原反应,甲醛与新制的Cu(OH)2发生的是氧化反应
C.为了鉴别己烯、甲苯和丙醛,可以使用新制Cu(OH)2悬浊液与溴水
D.乙醇的球棍模型为:![]() ,分子式为CH3CH2OH
,分子式为CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废旧镀锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程图如下:
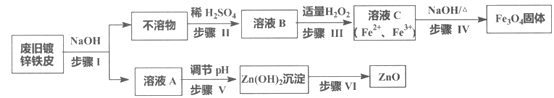
已知反应:①Zn+2NaOH=Na2ZnO2+H2↑ ②Zn(OH)2+2NaOH=Na2ZnO2+2H2O
回答下列问题:
(1)步骤I中的分离操作名称是_______,溶液A中的溶质有_______(填化学式)。
(2)步骤III中反应的离子方程式是___________________________________。
(3)步骤IV中反应的离子方程式是____________________________。
(4)步骤V可选用的试剂是_______(填序号)。
a. NaOH溶液 b. 氨水 c. 盐酸
(5)步骤VI的实验操作是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物阿佐昔芬G主要用于防治骨质疏松症和预防乳腺癌。合成路线如下:

⑴A中官能团的名称为_______;B→C的反应类型是_______。
⑵试剂M的分子式为C7H8OS,写出M的结构简式_______。
⑶D的一种同分异构体X同时满足下列条件,写出X的结构简式:______。
Ⅰ.能与FeCl3溶液发生显色反应,1 mol X最多可以消耗足量溴水中1 mol Br2;
Ⅱ.核磁共振氢谱上有4种不同化学环境的氢原子。
⑷![]() 是合成所需的原料之一,它的一种同分异构体Y同时满足下列条件,写出Y的结构简式:_______。
是合成所需的原料之一,它的一种同分异构体Y同时满足下列条件,写出Y的结构简式:_______。
Ⅰ.属于α-氨基酸; Ⅱ.含苯环,核磁共振氢谱上有6种不同化学环境的氢原子。
⑸请以CH2=CH2和![]() 为原料制备
为原料制备 的合成路线图____________________。(无机试剂任用,合成路线图示例见题干)
的合成路线图____________________。(无机试剂任用,合成路线图示例见题干)
⑹已知:![]() 。请写出以
。请写出以 和CH3Br为原料制备
和CH3Br为原料制备 的合成路线图______________________________________。(无机试剂任用,合成路线图示例见题干)。
的合成路线图______________________________________。(无机试剂任用,合成路线图示例见题干)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com