

| A. | 1mol该有机物最多可以和4mol Na反应 | |
| B. | 该有机物容易发生加成、取代、中和、消去等反应 | |
| C. | 该有机物遇FeCl3溶液不变色,但可使酸性KMnO4溶液褪色 | |
| D. | 1mol该有机物与浓溴水反应,最多消耗3mol Br2 |
分析 由图可知,分子中含酚-OH、-COOH、-COOC-、碳碳双键,结合酚、羧酸、酯、烯烃的性质来解答.
解答 解:A.只有酚-OH、-COOH与Na反应,则1mol该有机物最多可以和3mol Na反应,故A错误;
B.该有机物容易发生加成、取代、中和反应,不能发生消去反应,故B错误;
C.含酚-OH,遇FeCl3溶液变色,可使酸性KMnO4褪色,故C错误;
D.酚-OH的邻对位与溴水反应,碳碳双键与溴水发生加成反应,1mol该有机物与浓溴水反应,最多消耗3mol Br2,故D正确;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重酚、羧酸、酯、烯烃的性质及分析与应用能力的考查,题目难度不大.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:填空题

| 实验编号 | 滴加的试剂 | 实验现象 | 证明存在的微粒 (填微粒符号) |
| A | AgNO3 溶液 | a.产生白色沉淀 | b.Cl- |
| B | 紫色石蕊溶液 | c.先变红色后褪色 | d.H+,HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
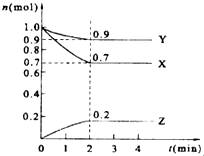 某温度时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅是非金属 | |
| B. | 它是非金属氧化物 | |
| C. | 二氧化硅能跟氢氧化钠反应生成盐和水 | |
| D. | 它的对应水化物是弱酸,能溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 操作 | 现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上方略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2,停止加热,一段时间后关闭 | --- |
| 从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl MgCl2NH4Cl | B. | H2O Na2O? CO2 | ||
| C. | CaCl2? NaOH H2O | D. | NH3•H2O CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com