


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
为了验证碱金属元素和第三周期金属元素金属性的相对强弱,某课外活动小组的同学设计如下实验,请根据要求回答下列问题:
(1)取少量金属钠和金属钾分别放入盛 的烧杯中,观察到钾的现象是 ;由此得出的结论是 。
(2)将镁条打磨至银白色后放入盛有上述物质的试管中, 明显现象(填“有”或“没有”), 后(填操作名称)可观察到有大量气泡产生,反应的化学方程式是 ;
(3)将打磨好的镁条和铝条分别放入盛 的试管中,观察到明显的现象,铝条反应的离子方程式是 ,由(1)(2)(3)可得出的结论是 ;
(4)某同学在学习了电化学基础知识后,设计了如图所示(X、Y分别是Mg、Al)的装置进行实验,发生氧化反应的负极金属性强,但发现镁条上有气体产生,由此得出了与实验(3)相反的结论,你知道这位同学所用的Z溶液是 ,其负极的电极反应式是
查看答案和解析>>
科目:高中化学 来源:2011届陕西省西安中学高三第十三次模拟考试(理综)化学试题 题型:实验题
为了验证碱金属元素和第三周期金属元素金属性的相对强弱,某课外活动小组的同学设计如下实验,请根据要求回答下列问题:
(1)取少量金属钠和金属钾分别放入盛 的烧杯中,观察到钾的现象是 ;由此得出的结论是 。
(2)将镁条打磨至银白色后放入盛有上述物质的试管中, 明显现象(填“有”或“没有”), 后(填操作名称)可观察到有大量气泡产生,反应的化学方程式是 ;
(3)将打磨好的镁条和铝条分别放入盛 的试管中,观察到明显的现象,铝条反应的离子方程式是 ,由(1)(2)(3)可得出的结论是 ;
(4)某同学在学习了电化学基础知识后,设计了如图所示(X、Y分别是Mg、Al)的装置进行实验,发生氧化反应的负极金属性强,但发现镁条上有气体产生,由此得出了与实验(3)相反的结论,你知道这位同学所用的Z溶液是 ,其负极的电极反应式是 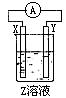
查看答案和解析>>
科目:高中化学 来源:2010-2011学年陕西省高三第十三次模拟考试(理综)化学试题 题型:实验题
为了验证碱金属元素和第三周期金属元素金属性的相对强弱,某课外活动小组的同学设计如下实验,请根据要求回答下列问题:
(1)取少量金属钠和金属钾分别放入盛 的烧杯中,观察到钾的现象是 ;由此得出的结论是 。
(2)将镁条打磨至银白色后放入盛有上述物质的试管中, 明显现象(填“有”或“没有”), 后(填操作名称)可观察到有大量气泡产生,反应的化学方程式是 ;
(3)将打磨好的镁条和铝条分别放入盛 的试管中,观察到明显的现象,铝条反应的离子方程式是 ,由(1)(2)(3)可得出的结论是 ;
(4)某同学在学习了电化学基础知识后,设计了如图所示(X、Y分别是Mg、Al)的装置进行实验,发生氧化反应的负极金属性强,但发现镁条上有气体产生,由此得出了与实验(3)相反的结论,你知道这位同学所用的Z溶液是
,其负极的电极反应式是

查看答案和解析>>
科目:高中化学 来源:2013届福建省高一下学期期中考试化学试卷 题型:实验题
(18分)[探究实验一] 某同学探究同周期主族元素性质递变规律时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系):
|
实验步骤 |
实验现象 |
|
1.将镁条用砂纸打磨后,放入沸水中;再向溶液中滴加酚酞溶液 |
A. 浮在水面上,熔成小球,做不定向运动,随之消失,溶液变成红色。 |
|
2.向新制得的Na2S溶液中滴加少量新制的氯水 |
B.有气体产生,溶液变成浅红色 |
|
3.将一小块钠放入滴有酚酞溶液的冷水中 |
C.剧烈反应,迅速产生大量无色气体。 |
|
4.将镁条投入稀盐酸中 |
D.反应不十分剧烈,产生无色气体 |
|
5.将铝条投入稀盐酸中 |
E.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:探究同周期主族元素性质递变规律。
(2)实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液。仪器:① ,② ,③ ,试管夹,镊子,小刀,玻璃片,砂纸,酒精灯等。
(3)实验内容:(填写与实验步骤对应的实验现象的编号和离子方程式)
|
实验内容 |
实验现象 |
离子方程式 |
|
1 |
|
|
|
2 |
|
|
|
3 |
|
|
|
4 |
|
|
|
5 |
|
|
(4)若用最高价氧化物的水化物的碱性相对强弱来验证Mg、Al失电子能力的强弱,请你设计实验(实验用品自选,不要求写化学方程式):
;
(5)实验结论: ;
[探究实验二] 一定条件下,氯化镁与四氯化钛的混合物可作烯烃聚合反应
的催化剂。为了探究温度、氯化镁固体的含水量以及粉碎方式对该催化剂催化
效果的影响,设计如下对比实验:
|
实验 序号 |
氯化镁固体中氯元素含量/% |
温度/℃ |
粉碎方式/ |
催化效果/g·g-1 |
|
1 |
70.97 |
20 |
滚动球磨 |
3.9×104 |
|
2 |
74.45 |
20 |
滚动球磨 |
5.0×104 |
|
3 |
74.45 |
20 |
振动球磨 |
5.9×104 |
|
4 |
|
100 |
振动球磨 |
|
(注:催化效果用单位时间内每克催化剂得到产品的质量来表示)
(6)表中 =
;
=
;
(7)从实验1、2可以得出的结论是: ;
(8)设计实验2、3的目的是: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com