某兴趣小组在实验室用加热乙醇、浓H
2SO
4、溴化钠和少量水的混合物来制备溴乙烷,检验反应的部分副产物,并探究溴乙烷的性质.

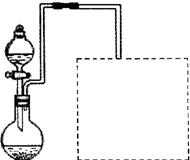
(一)溴乙烷的制备及产物的检验:设计了如图1装置,其中夹持仪器、加热仪器及冷却水管没有画出.请根据实验步骤,回答下列问题:
(1)竖直冷凝管冷凝水流向
口进
口出,竖直冷凝管冷凝的作用
.
(2)制备操作中,加入的少量的水,其目的是
;(填字母)
a.减少副产物烯和醚的生成 b.减少Br
2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(3)该实验装置中
装置可防止倒吸,中学化学实验中
用此方法防止倒吸.
(4)理论上,上述反应的副产物还可能有:乙醚(CH
3CH
2-O-CH
2CH
3)、乙烯、溴化氢等:检验副产物中是否含有溴化氢:熄灭酒精灯,在竖直冷凝管上方塞上塞子、打开a,利用余热继续反应直至冷却,通过B、C装置检验.B、C中应盛放的试剂分别是
、
.
(5)欲除去溴乙烷中的少量杂质Br
2,下列物质中最适合的是
.(填字母)
a.NaI b.NaOH c.NaHSO
3 d.KCl
(二)溴乙烷性质的探究:
用如图2实验装置(铁架台、酒精灯略) 验证溴乙烷的性质:
Ⅰ:在试管中加入10mL 6mol/L NaOH溶液和2mL溴乙烷,振荡.
Ⅱ:将试管如图2固定后,水浴加热.
(6)观察到
现象时,表明溴乙烷与NaOH溶液已完全反应.
(7)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,将生成的气体通入如图3装置.A试管中的水的作用是
,若无A试管,B试管中的试剂应为
.