
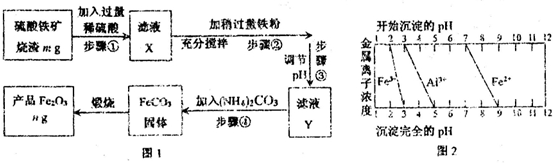
| n |
| 240 |
| ||
| m |
| 2n |
| 3m |
| 2n |
| 3m |
| 2n |
| 3m |


科目:高中化学 来源: 题型:
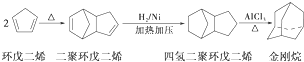
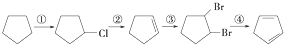
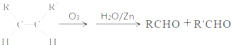 .请写出下列反应产物的结构简式:
.请写出下列反应产物的结构简式: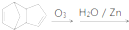
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯酚和甲醛在一定条件下可合成酚醛树脂 |
B、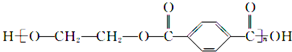 的单体是HOCH2CH2OH与 的单体是HOCH2CH2OH与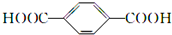 |
| C、聚苯乙烯是由苯乙烯加聚生成的纯净物 |
D、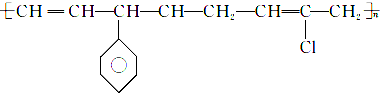 的单体有3种 的单体有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 品名 | 浓缩菠萝汁 |
| 配料 | 水、浓缩菠萝汁、蔗糖、柠檬酸、甜蜜素、维生素C、菠萝香精、柠檬黄、日落黄、山梨酸钾等 |
| 果汁含量 | ≥80%生产日期标于包装袋封口上 |
查看答案和解析>>
科目:高中化学 来源: 题型:
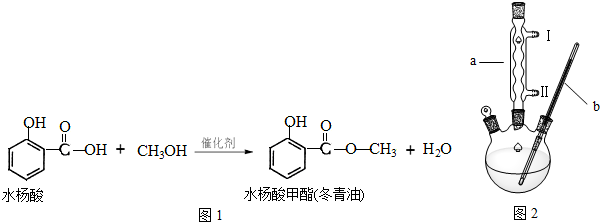
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作、现象 | 实验结论 |
| A | 向某溶液中加入Ba(NO3)2溶液,生成白色沉淀,再加入稀盐酸沉淀不消失 | 该溶液中含有SO42- |
| B | 用铂丝蘸取某溶液进行焰色反应, 火焰呈黄色 | 该溶液中一定含有Na+, |
| C | 将硫酸酸化的H2O2滴入Fe(NO3)2溶液,溶液变为黄色 | H2O2的氧化性比Fe3+强 |
| D | 向溶液中加入新制氯水,再加几滴KSCN溶液溶液变红 | 该溶液中一定含有Fe2+ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子半径 | 酸性 | 还原性 | 得电子能力 |
| N3- | H2SO4 | O2- | 35Cl |
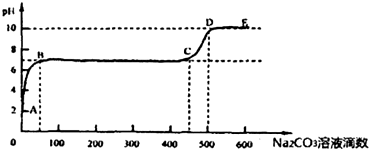
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液中C(H+)≠C(OH-) |
| B、100℃时,Na2CO3溶液中KW=1×10-14 |
| C、100℃时,0.1 mol?L-1NaOH溶液pH=11 |
| D、100℃时,0.1 mol?L-1H2SO4溶液中,水电离产生C(H+)=1.0×10-11mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com