
��14�֣��״��������ѵȱ���Ϊ��ɫ��Դ����ҵ��������Ȼ��Ϊ��Ҫԭ���������̼��ˮ������һ���������Ʊ��ϳ�����CO��H2�������Ƴɼ״��������ѣ�CH3OCH3����
��1����֪1g������������ȫȼ�������ȶ���������ų�������Ϊ32kJ����д��������ȼ���ȵ��Ȼ�ѧ����ʽ____________________________________________________________________��
��2��д�������Ѽ���ȼ�ϵ�صĸ����缫��Ӧʽ __________________________________��
��3���úϳ����Ʊ������ѵķ�Ӧԭ��Ϊ��2CO(g) + 4H2(g) CH3OCH3(g) + H2O(g)����֪һ�������£��÷�Ӧ��CO��ƽ��ת�������¶ȡ�Ͷ�ϱ�[n(H2) / n(CO)]�ı仯����������ͼ��
CH3OCH3(g) + H2O(g)����֪һ�������£��÷�Ӧ��CO��ƽ��ת�������¶ȡ�Ͷ�ϱ�[n(H2) / n(CO)]�ı仯����������ͼ��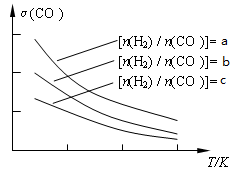
��a��b��c���Ӵ�С��˳������Ϊ_________________���÷�Ӧ�ġ�H_______0�������������������
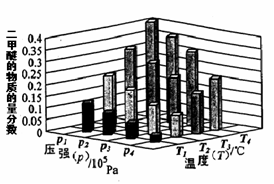
��ij�¶��£���2.0molCO(g)��4.0molH2(g)�����ݻ�Ϊ2L���ܱ������У���Ӧ����ƽ��ʱ���ı�ѹǿ���¶ȣ�ƽ����ϵ��CH3OCH3(g)�����ʵ��������仯�������ͼ��ʾ�������¶Ⱥ�ѹǿ�Ĺ�ϵ�ж���ȷ���� ��
A. P3��P2��T3��T2 B. P1��P3��T1��T3 C. P2��P4��T4��T2 D. P1��P4��T2��T3
���ں����ܱ������ﰴ�����Ϊ1:2����һ����̼��������һ�������·�Ӧ�ﵽƽ��״̬�����ı䷴Ӧ��ijһ�����������б仯��˵��ƽ��һ�����淴Ӧ�����ƶ����� ��
A. ����Ӧ������������С B. �淴Ӧ������������С
C. ��ѧƽ�ⳣ��Kֵ��С D. ������ת���ʼ�С
�� ij�¶��£���4.0molCO��8.0molH2�����ݻ�Ϊ2L���ܱ������У���Ӧ�ﵽƽ��ʱ����ö����ѵ��������Ϊ25%������¶��·�Ӧ��ƽ�ⳣ��K��__________��
��1��CH3OCH3(g) + 3O2(g)��2CO2(g) + 3H2O(l) ��H��-1472kJ/mol
��2��CH3OCH3 -12e- + 16OH-��2CO32- + 11H2O
��3����a��b��c���� ��B��D ��B��C �� 2.25
���������������1��1g������������ȫȼ�������ȶ���������ų�������Ϊ32kJ����1mol�����Ѽ�46g��������ȫȼ�������ȶ���������ų�������Ϊ46��32kJ��1472kJ����˶�����ȼ���ȵ��Ȼ�ѧ����ʽΪCH3OCH3(g) + 3O2(g)��2CO2(g) + 3H2O(l) ��H��-1472kJ/mol��
��2��ԭ����и���ʧȥ���ӣ���˶������ڸ���ͨ�룬����������Ӧ����������Լ��ԣ�������ѵ������������ձ�Ϊ̼���Σ���˶����Ѽ���ȼ�ϵ�صĸ����缫��ӦʽΪCH3OCH3 -12e- + 16OH-��2CO32- + 11H2O��
��3����������CO���Ƿ�Ӧ����Ͷ�ϱ�[n(H2) / n(CO)]Խ��CO��ת����Խ�����Ը���ͼ���֪a��b��c��ͬ������ͼ���֪�����¶�CO��ת���ʽ��ͣ���˵�������¶�ƽ�����淴Ӧ�����ƶ����������Ӧ�Ƿ��ȷ�Ӧ������H��0��
�ڸ���ͼ����Կ��������ڷ�Ӧ��2CO(g) + 4H2(g) CH3OCH3(g) + H2O(g) ��H��0��ѹǿԽ�����ѵ����ʵ���������Խ���¶�Խ�ߣ������ѵ����ʵ�������ԽС������P1��P3��T1��T3��P1��P4��T2��T3���ʴ�Ϊ��BD��
CH3OCH3(g) + H2O(g) ��H��0��ѹǿԽ�����ѵ����ʵ���������Խ���¶�Խ�ߣ������ѵ����ʵ�������ԽС������P1��P3��T1��T3��P1��P4��T2��T3���ʴ�Ϊ��BD��
�ۻ�ѧƽ��ı�־�����淴Ӧ������ȣ����淴Ӧ���ʴ�������Ӧ����ʱ��˵����Ӧ��������еġ�A������Ӧ������������С��˵��ƽ��������Ӧ�����ƶ���A����ȷ��B���淴Ӧ������������С��˵��ƽ�����淴Ӧ�����ƶ���B��ȷ��C����ѧƽ�ⳣ������һ�������£������淴Ӧ�ﵽƽ��״̬ʱ��������Ũ�ȵ���֮���ͷ�Ӧ��Ũ�ȵ���֮���ı�ֵ����˻�ѧƽ�ⳣ��Kֵ��С��˵��ƽ�����淴Ӧ�����ƶ���C��ȷ��D��������ת���ʼ�С�����ж�ƽ���ƶ�����D����ȷ���ʴ�Ϊ��BC��
�ܸ��ݷ�Ӧ�Ļ�ѧ����ʽ��֪��
2CO(g) + 4H2(g) CH3OCH3(g) + H2O(g)
CH3OCH3(g) + H2O(g)
��ʼŨ�ȣ�mol/L�� 2 4 0 0
ת��Ũ�ȣ�mol/L�� 2x 4x x x
ƽ��Ũ�ȣ�mol/L��2��2x 4��4x x x
��Ӧ�ﵽƽ��ʱ����ö����ѵ��������Ϊ25%
��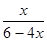 ��0.25
��0.25
���x��0.75
���Ը��¶���ƽ�ⳣ��K��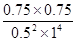 ��2.25
��2.25
���㣺�����Ȼ�ѧ����ʽ��д����������Է�Ӧ���ʺ�ƽ��״̬��Ӱ���Լ�ƽ�ⳣ���ļ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���д�ʩ�п϶���ʹ��ѧ��Ӧ�����������
| A�������¶� | B��ʹ�ô��� |
| C������ѹǿ | D������Ӧ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��5�֣��ڹ̶��ݻ����ܱ������У��п��淴ӦnA(g)+mB(g) pC(g)����ƽ��״̬(��֪n+m��p����H>0���������¶�ʱc(B)/c(C)�ı�ֵ �����������ܶ� ������ʱ����������ƽ����Է������� ���������������������ʵ��� ������C����A��B�����ʵ��� ����������С�����䡢��ȷ����
pC(g)����ƽ��״̬(��֪n+m��p����H>0���������¶�ʱc(B)/c(C)�ı�ֵ �����������ܶ� ������ʱ����������ƽ����Է������� ���������������������ʵ��� ������C����A��B�����ʵ��� ����������С�����䡢��ȷ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(18��)��Դ�Ŀ����������ǵ�ǰ��ѧ�о�����Ҫ���⡣
(1)���ö�������(CeO2)��̫����������ǰʵ�����±��Ϊ���Ĺ��̣�
mCeO2 (m-x)CeO2
(m-x)CeO2 xCe+xO2
xCe+xO2
(m-x)CeO2 xCe+xH2O+xCO2
xCe+xH2O+xCO2 mCeO2+xH2+xCO
mCeO2+xH2+xCO
�������̵��ܷ�Ӧ�� ,�÷�Ӧ��̫����ת��Ϊ ��
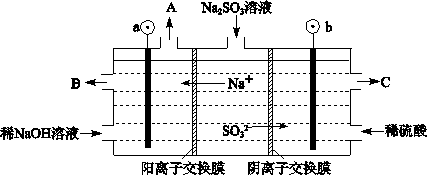
(2)CO��O2��KOH��Һ���ɵ�ȼ�ϵ�صĸ����缫��ӦʽΪ ���õ�ط�Ӧ�ɻ��K2CO3��Һ��ij�¶���0.5mol L-1 K2CO3��Һ��pH=12��������CO32-�ĵڶ���ˮ�⣬��CO32- +H2O
L-1 K2CO3��Һ��pH=12��������CO32-�ĵڶ���ˮ�⣬��CO32- +H2O HCO3-+OH-��ƽ�ⳣ��Kh= ��
HCO3-+OH-��ƽ�ⳣ��Kh= ��
(3)�ȼҵ�Ǹߺ��ܲ�ҵ�����н�������ȼ�ϵ������ϵĹ��տ��Խ���30�����ϡ�
�ٵ������з�����Ӧ�����ӷ���ʽ�� ������������ҺPH (����䡱�������ߡ����½���)��
�����������SO42-�����ϸߣ����ƹ��������ӱ��Լ���ȥSO42-���ñ��Լ���ѡ�������Լ��е� ��
a��Ba(OH)2 b��Ba(NO3)2 c��BaCl2
�ִ������и���ʹ��BaCO3��SO42-����д��������Ӧ�����ӷ���ʽ ��
��ͼ������������Һ����������a�� b��(�>��������=����<��)����ȼ�ϵ���и����Ϸ����ĵ缫��ӦΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(8��)ijѧ��Ϊ��̽��п�����ᷴӦ�����е����ʱ仯������100 mLϡ�����м���������п�ۣ�����ˮ�������ռ���Ӧ�ų���������ʵ���¼����(�ۼ�ֵ�����������Ϊ������)��
| ʱ��(min) | 1 | 2 | 3 | 4 | 5 |
| �������(mL) | 50 | 120 | 232 | 290 | 310 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(15��)�����仯�����������������ϵ���С�
��1����ͼ��ʵ�����о���ˮ����բ��ͬ��λ��ʴ���������ʾ��ͼ��
�ٸõ绯��ʴ��Ϊ ��
��ͼ��A��B��C��D�ĸ������������������� (����ĸ)��
��2���÷���Ƥ��ȡ����(Fe2O3)�IJ�������ʾ��ͼ���£�
�ٲ���I���¶ȹ��ߣ�����������ֽ⡣����ֽ�Ļ�ѧ����ʽΪ ��
�ڲ�����з�����Ӧ��4Fe(NO3)2��O2��(2n��4)H2O��2Fe2O3��nH2O��8HNO3����Ӧ������HNO3�ֽ�����Ƥ�е���ת��ΪFe(NO3)2���÷�Ӧ�Ļ�ѧ����ʽΪ ��
���������������У������֡���ɫ��ѧ��˼����� (��дһ��)��
��3����֪t��ʱ����ӦFeO(s)��CO(g) Fe(s)��CO2(g)��ƽ�ⳣ��K��0.25��
Fe(s)��CO2(g)��ƽ�ⳣ��K��0.25��
��t��ʱ����Ӧ�ﵽƽ��ʱn(CO)��n(CO2)�� ��
������1 L�ܱ������м���0.02 mol FeO(s)����ͨ��xmolCO��t��ʱ��Ӧ�ﵽƽ�⡣��ʱFeO(s)ת����Ϊ50%����x�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(10��)ijͬѧ�������ͼ��ʾ��װ�ã��г�װ������ȥ����̽��Ӱ�컯ѧ��Ӧ���ʵ����ء�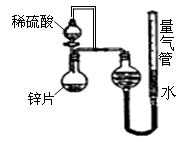
��1��Բ����ƿ�з�����Ӧ�����ӷ���ʽ��
__________________________________________
��2��������װ�ý���ʵ�飬������15.0mL����Ϊ��ʱ�յ㣬
���Ϊt1��t2
| ��� | ��(H2SO4)/mL | C(H2SO4)/mol��L-1 | t/s |
| �� | 10 | 1 | t1 |
| �� | 10 | 3 | t2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��14�֣���ҵ����������β���ŷų���SO2��NOx�ȣ����γ���������Ҫ���ء������ɿ����еĻҳ������ᡢ���ᡢ�л�̼�⻯����������γɵ�������
��1�������е�SO2���̳��Ĵ����γ�����ķ�Ӧ����ʽ��____________________��
��2����֪2SO2 (g)+ O2 (g) 2SO3(g) ��H����196kJ/mol����߷�Ӧ��SO2��ת���ʣ��Ǽ���SO2�ŷŵ���Ч��ʩ��
2SO3(g) ��H����196kJ/mol����߷�Ӧ��SO2��ת���ʣ��Ǽ���SO2�ŷŵ���Ч��ʩ��
��T�¶�ʱ����2L�ݻ��̶�������ܱ������м���2.0 mol SO2��1.0 mol O2��5 min��Ӧ�ﵽƽ�⣬���������ת����Ϊ50%�����(O2)��____________��
���ڢٵ������£��жϸ÷�Ӧ�ﵽƽ��״̬�ı�־��_______(����ĸ)��
| A��SO2��O2��SO3���ߵ�Ũ��֮��Ϊ2��1��2 | B�������������ѹǿ���� |
| C�������ڻ��������ܶȱ��ֲ��� | D��SO3�����ʵ������ٱ仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
һ���¶��£����ܼ�Ϊ1L���ܱ������ڷ���2molN2O4��8molNO2���������·�Ӧ2 NO2(����ɫ) N2O4(��ɫ) ��H��0��Ӧ��NO2��N2O4�����ʵ����淴Ӧʱ��仯����������ͼ��������Ҫ������
N2O4(��ɫ) ��H��0��Ӧ��NO2��N2O4�����ʵ����淴Ӧʱ��仯����������ͼ��������Ҫ������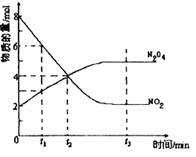
��1���ڸ��¶��£���Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ�� ��
��2����t1��10s��t2��20s�������t1��t2ʱ��N2O4��ʾ�ķ�Ӧ���ʣ� mol�� L-1�� s-1��
��3��ͼ��t1��t2��t3��һ��ʱ�̱�ʾ��Ӧ�Ѿ��ﵽƽ�⣿�� ��
��4��t1ʱ������Ӧ���� ����������������������淴Ӧ���ʡ�
��5��ά���������¶Ȳ��䣬����С�������������ƽ���� �ƶ��������Ӧ�������淴Ӧ�����䡱��
��6��ά��������������䣬�����¶ȣ��ﵽ��ƽ��ʱ��ϵ����ɫ ������������dz�����䡱����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com