
 数十年来,化学工作者对碳的氧化物做了广泛深入的研究并取得了一些重要成果.
数十年来,化学工作者对碳的氧化物做了广泛深入的研究并取得了一些重要成果.
| ||
| 1 |
| 2 |
| 1 |
| 2 |
| ||
| 催化剂 |
| ||
| 催化剂 |
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、P、S、Cl元素最高正价依次升高 |
| B、N、O、F第一电离能依次增大 |
| C、Na、Mg、Al原子最外层电子数依次增多 |
| D、Na、K、Rb电负性逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、葡萄糖的结构简式:C6H12O6 | ||
| B、NaHCO3的电离:NaHCO3═Na++H++CO32- | ||
C、质子数为53、中子数为78的碘原子:
| ||
D、CO2的电子式: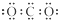 |
查看答案和解析>>
科目:高中化学 来源: 题型:
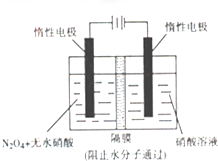
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、-44.2kJ?mol-1 |
| B、+44.2kJ?mol-1 |
| C、-330kJ?mol-1 |
| D、+330kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

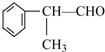
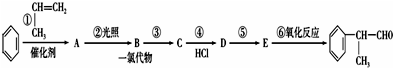
查看答案和解析>>
科目:高中化学 来源: 题型:
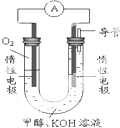 甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景.
甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景.| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com