
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ |
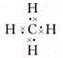 .
.分析 由元素在周期表的位置可知,元素①~⑧分别为C、N、O、F、Na、Al、S、Cl,
(1)F的非金属性最强,地壳中含量最高的元素为O;
(2)①的最简单的气态氢化物为甲烷;
(3)第三周期主族元素中Cl的非金属性最强,S对应的硫酸为二元酸;
(4)②的气态氢化物为氨气,②的最高价氧化物对应水化物为硝酸,二者反应生成硝酸铵.
解答 解:由元素在周期表的位置可知,元素①~⑧分别为C、N、O、F、Na、Al、S、Cl,
(1)地壳中含量最高的元素为O,非金属性最强的元素为F,故答案为:O;F;
(2)①的最简单的气态氢化物为甲烷,其电子式为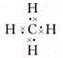 ,故答案为:
,故答案为: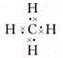 ;
;
(3)第三周期主族元素中Cl的非金属性最强,单质氧化性最强的是氯气,S对应的硫酸为二元酸,能形成的二元强酸是H2SO4,故答案为:氯气;H2SO4;
(4)②的气态氢化物为氨气,②的最高价氧化物对应水化物为硝酸,二者反应生成硝酸铵,反应方程式为NH3+HNO3=NH4NO3,故答案为:NH3+HNO3=NH4NO3.
点评 本题考查位置、结构与性质关系的应用,为高频考点,把握元素周期表结构、元素周期律内容为解答的关键,试题侧重考查学生的分析、理解能力及灵活应用能力,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题

| A. | m+n<p+q△H>0 | B. | m+n>p+q△H>0 | C. | m+n<p+q△H<0 | D. | m+n>p+q△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| 溶解度 (g/100g水) | 0 | 28 | 35.7 | 4.7 | 163 |
| 40 | 40.1 | 36.4 | 26.3 | 215 | |
| 80 | 51.3 | 38 | 73 | 376 | |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
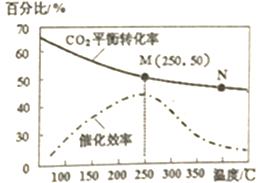 一定条件下合成乙烯6H2(g)+2C02(g)$\frac{\underline{\;催化剂\;}}{\;}$CH2=CH2(g)+4H20(g);己知温度对C02的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是( )
一定条件下合成乙烯6H2(g)+2C02(g)$\frac{\underline{\;催化剂\;}}{\;}$CH2=CH2(g)+4H20(g);己知温度对C02的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是( )| A. | 生成乙烯的速率:v(M)一定小于v(N) | |
| B. | 平衡常数:KM<KN | |
| C. | 催化剂对CO2的平衡转化率没有影响 | |
| D. | 若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制催化剂的材料 | B. | 耐高温、耐腐蚀的合金材料 | ||
| C. | 半导体材料 | D. | 制农药的材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
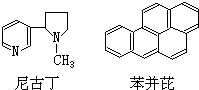 吸烟是人类的一种不良嗜好,也是生活环境中的特殊大气污染源,它对人体健康危害极大,据分析吸烟生成的物质至少有700多种,其中大部分为有毒有害物质.危害最大的物质中有两种是尼古丁和苯并芘,前者的成人致死量约为40~60mg,相当于一包香烟产生的尼古丁的总量;后者是最强的致癌物之一.它们的结构简式分别为:
吸烟是人类的一种不良嗜好,也是生活环境中的特殊大气污染源,它对人体健康危害极大,据分析吸烟生成的物质至少有700多种,其中大部分为有毒有害物质.危害最大的物质中有两种是尼古丁和苯并芘,前者的成人致死量约为40~60mg,相当于一包香烟产生的尼古丁的总量;后者是最强的致癌物之一.它们的结构简式分别为:| A. | 尼古丁的分子式为C10H14N2 | |
| B. | 尼古丁分子中的所有原子都在同一平面上 | |
| C. | 苯并芘的分子式为C20H18 | |
| D. | 苯并芘分子中含有苯环结构单元,是苯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO32-和Br-浓度都会减小 | B. | 溶液颜色会发生变化 | ||
| C. | 该过程中不会有沉淀生成 | D. | 离子浓度基本保持不变的只有Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100kg | B. | 160kg | C. | 240kg | D. | 300kg |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com