
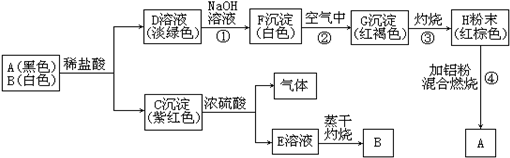
分析 混合物中含有物质A和B,已知A为黑色粉末,B为白色粉末,混合物与盐酸反应得到淡绿色D溶液与紫红色C沉淀,D与氢氧化钠反应得到白色沉淀F,F在空气中转化为红褐色沉淀G,G灼烧得到红棕色粉末H,H与Al反应得到A,则A为Fe、D为亚铁盐、F为Fe(OH)2、G为Fe(OH)3、H为Fe2O3,C能与浓硫酸反应得到气体及E的溶液,E溶液加热得到B,则B为CuSO4,C为Cu,D为FeSO4、FeCl2混合物,据此解答.
解答 解:混合物中含有物质A和B,已知A为黑色粉末,B为白色粉末,混合物与盐酸反应得到淡绿色D溶液与紫红色C沉淀,D与氢氧化钠反应得到白色沉淀F,F在空气中转化为红褐色沉淀G,G灼烧得到红棕色粉末H,H与Al反应得到A,则A为Fe、D为亚铁盐、F为Fe(OH)2、G为Fe(OH)3、H为Fe2O3,C能与浓硫酸反应得到气体及E的溶液,E溶液加热得到B,则B为CuSO4,C为Cu,D为FeSO4、FeCl2混合物.
(1)A为Fe,B为CuSO4,C为Cu,D为FeSO4、FeCl2,G为Fe(OH)3,
故答案为:Fe;CuSO4;Cu;FeSO4、FeCl2;Fe(OH)3;
(2)写出①、②、③、④四处变化的化学方程式:
反应①的化学方程式为:FeCl2+2NaOH=Fe(OH)2↓+2NaCl;
反应②的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
反应③的化学方程式为:2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O;
反应④的化学方程式为:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,
故答案为:FeCl2+2NaOH=Fe(OH)2↓+2NaCl;4Fe(OH)2+O2+2H2O=4Fe(OH)3;2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O;Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
点评 本题考查无机物推断,涉及Fe、Cu元素等单质化合物性质,物质的颜色及反应信息为推断突破口,熟练掌握元素化合物性质.


 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:解答题
| 试剂 温度 | T1/℃ | T2/℃ | T3/℃ |
| Na2CO3 | 23.3 | 20.0 | 23.7 |
| NaHCO3 | 18.5 | 20.0 | 20.8 |
温度 溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
| Na2CO3 | 12.5g | 21.5g | 39.7g | 40.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在加热条件下能使不活泼金属铜溶解,表现出浓硫酸的强氧化性和酸性 | |
| B. | 可以用铁制或铝制容器贮运,表现出浓硫酸有稳定的化学性质 | |
| C. | 能使胆矾晶体由蓝色变为白色,表现出浓硫酸的脱水性 | |
| D. | 能使蔗糖炭化,表现出浓硫酸的吸水性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
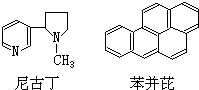 吸烟是人类的一种不良嗜好,也是生活环境中的特殊大气污染源,它对人体健康危害极大,据分析吸烟生成的物质至少有700多种,其中大部分为有毒有害物质.危害最大的物质中有两种是尼古丁和苯并芘,前者的成人致死量约为40~60mg,相当于一包香烟产生的尼古丁的总量;后者是最强的致癌物之一.它们的结构简式分别为:
吸烟是人类的一种不良嗜好,也是生活环境中的特殊大气污染源,它对人体健康危害极大,据分析吸烟生成的物质至少有700多种,其中大部分为有毒有害物质.危害最大的物质中有两种是尼古丁和苯并芘,前者的成人致死量约为40~60mg,相当于一包香烟产生的尼古丁的总量;后者是最强的致癌物之一.它们的结构简式分别为:| A. | 尼古丁的分子式为C10H14N2 | |
| B. | 尼古丁分子中的所有原子都在同一平面上 | |
| C. | 苯并芘的分子式为C20H18 | |
| D. | 苯并芘分子中含有苯环结构单元,是苯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; | 第一次 | 第二次 | 第三次 | 第四次 |
| 体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH+HCl═NaCl+H2O | B. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | ||
| C. | SO3+H2O═H2SO4 | D. | NH4HCO3 $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com