
| 0.448L |
| 22.4L/mol |
| 0.448L |
| 22.4L/mol |


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源: 题型:
 | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
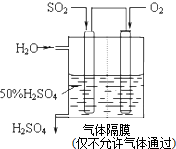
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
| 溶解 |
| ① |
| BaCl2 |
| ② |
| NaOH |
| ③ |
| Na2CO3 |
| ④ |
| 过滤 |
| ⑤ |
| 适量食盐 |
| ⑥ |
| 蒸发、结晶、烘干 |
| ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
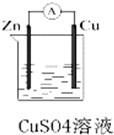 某化学兴趣小组利用如图所示原电池装置进行实验,请回答下列问题:
某化学兴趣小组利用如图所示原电池装置进行实验,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
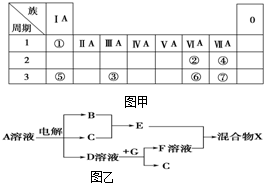 如图甲为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题:
如图甲为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
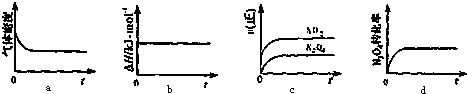
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在由氢氧化铜分解制氧化铜时,要边加热边用玻璃棒搅拌 |
| B、用药匙或者纸槽把粉末状药品送入试管的底部 |
| C、过滤时玻璃棒的末端应轻轻靠在三层的滤纸上 |
| D、刚完成蒸发结晶,因要做下一个实验,可以将蒸发皿先放在桌面上,冷却后收好 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com