
 .CaC2晶胞结构与氯化钠晶体相似,则在晶体中与钙离子距离最近的C22-数目为6,这些C22-在空间所围成的几何图形为正八面体
.CaC2晶胞结构与氯化钠晶体相似,则在晶体中与钙离子距离最近的C22-数目为6,这些C22-在空间所围成的几何图形为正八面体分析 (1)实验室一般用饱和食盐水代替水进行实验,以获得平稳的乙炔气流;
(2)硫化氢和硫酸铜反应生成沉淀,磷化氢易溶于水,据此解答即可;
(3)C22-与O22+和氮气互为等电子体,根据氮气分子电子式书写O22+电子式;氯化钠晶胞中配位数为6,每个阴离子周围距离最近且相等的阳离子数目为6,CaC2晶胞结构与氯化钠晶体相似,据此分析;
(4)根据物质的结构来分析;
(5)H2C=CH-C≡N中连接三键两端原子的原子位于同一直线上,位于碳碳双键两端碳原子的原子位于同一平面上;
(6)若乙炔与HCl发生加成后的产物可能为1,2-二氯乙烷和1,1-二氯乙烷,据此分析水解产物;
(7)气态烃0.5mol能与1molHCl加成,说明烃中含有1个C≡C键或2个C=C键,加成后产物分子上的氢原子又可被3molCl2完全取代,说明0.5mol二氯代物中含有3molH原子,即1mol二氯代物含有6molH原子,其中2molH原子由加成反应提供,故1mol烃含有含有4molH,并含有1个C≡C键或2个C=C键,以此解答该题.
解答 解:(1)为了控制水与电石的反应速率并得到平稳气流,采取的措施是用饱和食盐水代替水,故答案为:用饱和食盐水代替纯水;
(2)硫化氢和硫酸铜反应生成沉淀,磷化氢易溶于水,可用硫酸铜溶液或氢氧化钠溶液洗气除去,故答案为:CuSO4(或NaOH溶液);
(3)等电子体结构和性质相似,C22-与O22+和氮气互为等电子体,根据氮气分子电子式书写O22+电子式为 ;CaC2晶胞结构与氯化钠晶体相似,而
;CaC2晶胞结构与氯化钠晶体相似,而
氯化钠晶胞中配位数为6,每个阴离子周围距离最近且相等的阳离子数目为6,故在CaC2晶体中与钙离子距离最近的C22-数目为6,围成的空间构型为正八面体.
故答案为: ;6;正八面体;
;6;正八面体;
(4)A、Mg2C与水反应时,Mg2+结合水中的OH-生成Mg(OH)2,C4-结合H+生成CH4,故A正确;
B、SiCl4与水反应,Cl-生成了HCl,Si4+生成H4SiO4,故B正确;
C、Li2C2与水反应,Li+结合OH-生成LiOH,C22-结合H+生成C2H2,故C错误;
D、Li3N与水反应,Li+结合OH-生成LiOH,N3-结合H+生成生成NH3,故D正确.
故选ABD;
(5)H2C=CH-C≡N中连接三键两端原子的原子位于同一直线上,位于碳碳双键两端碳原子的原子位于同一平面上,所以该分子中位于同一直线上的原子为3个,
故答案为:3;
(6)若乙炔与HCl发生加成后的产物可能为1,2-二氯乙烷和1,1-二氯乙烷,1,2-二氯乙烷在氢氧化钠溶液中水解为乙二醇:CH2(OH)CH2OH;1,1-二氯乙烷在氢氧化钠溶液中先水解为1,1-乙二醇,但2个-OH连在同一个碳上的结构不稳定,易发生脱水生成CH3CHO,故答案为:CH2(OH)CH2OH、CH3CHO;
(7)气态烃0.5mol能与1molHCl加成,说明烃中含有1个C≡C键或2个C=C键,生成0.5mol二氯代物,加成后产物分子上的氢原子又可被3molCl2完全取代,说明0.5mol二氯代物中含有3molH原子,即1mol二氯代物含有6molH原子,其中2molH原子由加成反应提供,故1mol烃含有含有4molH,并含有1个C≡C键或2个C=C键,故可以为CH≡CCH3或HC≡C-CH2-C≡CH.故答案为:CH≡CCH3;HC≡C-CH2-C≡CH.
点评 本题考查有机物结构的推断、加成反应、取代反应,以及晶体的空间构型,题目难度不大,注意有机物的加成和取代反应特征.


 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:解答题
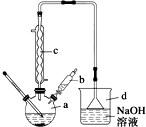 溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 在水中的溶解度 | 微溶 | 微溶 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.
W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
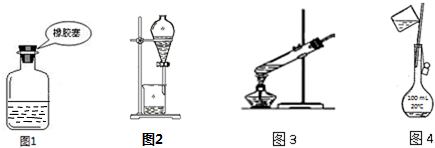
| A. | 图1装置:存放NaOH溶液 | |
| B. | 图2装置:分离乙酸乙酯和水 | |
| C. | 图3装置:葡萄糖的银镜反应 | |
| D. | 图4装置:配制 100 mL 1 mol/L NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ | Cl- |
| 处理前浓度/(mg•L-1) | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
| 处理后浓度/(mg•L-1) | 0.004 | 22.6 | 0.040 | 0.053 | 49.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 的烃,下列说法中正确的是( )
的烃,下列说法中正确的是( )| A. | 分子中至少有9个碳原子处于同一平面上 | |
| B. | 分子中至多有26个原子处于同一平面上 | |
| C. | 该烃能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色 | |
| D. | 该烃属于苯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X和W组成的化合物属于分子晶体 | |
| B. | Y的气态氢化物比Z的气态氢化物稳定 | |
| C. | X的单质既能与NaOH溶液反应,又能与氢氟酸反应 | |
| D. | 向KI-淀粉溶液中通入某气体后变蓝,则该气体一定是Z的单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com