
(10分)某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
| A.在250 mL容量瓶中定容成250 mL烧碱溶液; |
| B.用碱式滴定管移取25 mL烧碱溶液于锥形瓶中并滴加几滴甲基橙作指示剂; |
| C.在天平上准确称取烧碱样品m g,在烧杯中加蒸馏水溶解; |
| D.将物质的量浓度为c mol·L-1的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度为V1 mL; |
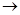
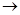
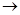 D
D 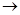 。
。(1)C;A;B;D;E;
(2)零刻度或零稍下的某一刻度(不完整不给分)
(3)由黄色变为橙色,且半分钟不变色
(4)偏高
(5)80(V2-V1)c/m %
解析试题分析:(1)正确操作步骤的顺序是C.称取品m g,溶解;配成成250 mL烧碱溶液;移取25 mL烧碱溶液,滴加指示剂;将标准H2SO4溶液装入滴定管,调整液面,记下开始刻度为;在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度。
(2)零刻度以上不能读数,操作D中液面应调整到零刻度或零稍下的某一刻度 。
(3)甲基橙作指示剂,用酸滴定碱,溶液从碱性滴定到终点,滴定终点的现象是由黄色变为橙色,且半分钟不变色 。
(4)若酸式滴定管没有用标准H2SO4润洗,标准H2SO4溶液被稀释,所用H2SO4溶液的体积会偏大,测定结果偏高。
(5)所用硫酸的体积为(V2-V1)/1000L,物质的量为cmol/L×(V2-V1)/1000L,所测氢氧化钠的物质的量为2cmol/L×(V2-V1)/1000L,烧碱样品中氢氧化钠的质量为[40g/mol×2cmol/L×(V2-V1)/1000L]×(25ml/250ml),该烧碱样品的纯度计算式是[40g/mol×2cmol/L×(V2-V1)/1000L]×(25ml/250ml)÷mg×100%= 80(V2-V1)c/m %。
考点:酸碱中和滴定的操作及计算


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案科目:高中化学 来源: 题型:单选题
下列哪一组元素的原子间反应容易形成离子键
| 原子 | a | b | c | d | e | f | g |
| M层电子数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙(其pH变色范围为3.1~4.4)作指示剂,下列操作中可能使测定结果偏低的是
| A.酸式滴定管在装酸液前未用标准盐酸润洗2~3次 |
| B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 |
| C.锥形瓶溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度 |
| D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
10分)某种胃药片的制酸剂为碳酸钙,其中所含的制酸剂质量的测定如下:
①需配制0.1 mol?L-1的盐酸和0.1mol?L-1的氢氧化钠溶液;
②每次取一粒(药片质量均相同)0.2g的此胃药片,磨碎后加入20.00mL蒸馏水;
③以酚酞为指示剂,用0.1mol?L-1的氢氧化钠溶液滴定,需用去VmL达滴定终点;
④加入25.00mL0.1mol?L-1的盐酸溶液。
(1)写出实验过程中第一次滴定①-④的编号顺序______________。
(2)下图所示的仪器中配制0.1mol?L-1盐酸和0.1mol?L-1氢氧化钠溶液肯定不需要的仪器是(填序号)_________,配制上述溶液还需要的玻璃仪器是(填仪器名称)__________。
(3)配制上述溶液应选用的容量瓶的规格是(重复滴定一次)__________________。
| A.50mL、50mL | B.100mL、100mL |
| C.100mL、150mL | D.250mL、250mL |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(4分)在25℃时,有pH为a的HCl溶液和pH为b的NaOH溶液,取VaL该盐酸溶液用该NaOH溶液中和,需VbL NaOH溶液,(题中a≤b,b≥8)。问:
(1)若a+b=14,则Va/Vb= .
(2)若a+b=13,则Va/Vb=
(3)若a+b>14,则Va/Vb= ,且Va Vb(填“>”“<”“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(8分)苯甲酸及其钠盐可用作乳胶、牙膏、果酱或其它食品的抑菌剂,也可广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,制备流程为:
操作步骤如下:① 将一定量的甲苯和碱性KMnO4溶液加热至沸腾,并冷凝回流至混合液不再分层。② 反应停止后,将反应混合液过滤,滤渣为黑色固体;得到的滤液如果呈紫色,可加入少量的饱和亚硫酸钠溶液使紫色褪去,重新过滤。③ 将②中所得滤液经一系列操作得到苯甲酸晶体。
已知:苯甲酸相对分子质量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;
(1)该实验合成苯甲酸钾可能用到的下列仪器有__________。
A.圆底烧瓶 B.蒸馏烧瓶 C.冷凝管 D.温度计
(2)第①步中被回流的主要物质是____________________。
(3)写出滴加饱和亚硫酸钠溶液时的离子方程式______________________________。
(4)步骤③得到苯甲酸晶体应进行操作是________(按操作顺序填正确答案序号)。
A.酸化 B.过滤 C.蒸发浓缩 D.冷却结晶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com