
分析 (1)①2SO2(g)+O2(g)$\stackrel{\;}{?}$2SO3(g)△H=-196.6kJ•mol-1;②2NO(g)+O2(g)$\stackrel{\;}{?}$2NO2(g)△H=-113.0kJ•mol-1,依据盖斯定律$\frac{①-②}{2}$得到热化学方程式;
(2)负极发生氧化反应,氨气被氧化生成氮气,结合化合价的变化计算生成气体的体积;
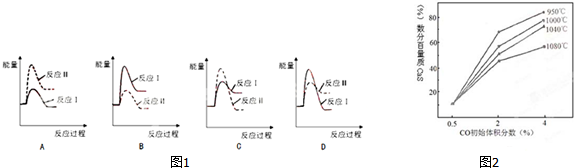
(3)达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变;
(4)5min后反应平衡,此时测得CH3OH的浓度为0.3mol/L,则v(CH3OH)=$\frac{0.3mol/L}{5min}$=0.06mol/(L•min),结合方程式计量关系计算v(H2);计算平衡时可各物质的浓度,可计算平衡常数;
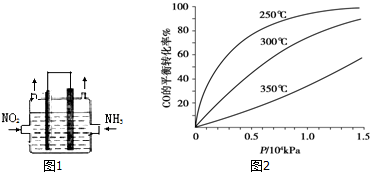
(5)从横坐标上一点,画一条平行于纵坐标的虚线,看相同压强下不同温度时CO的平衡转化率,温度越低转化率越低,说明,升温时平衡向逆向移动.
解答 解:(1)①2SO2(g)+O2(g)$\stackrel{\;}{?}$2SO3(g)△H=-196.6kJ•mol-1
②2NO(g)+O2(g)$\stackrel{\;}{?}$2NO2(g)△H=-113.0kJ•mol-1
依据盖斯定律$\frac{①-②}{2}$得到热化学方程式为:NO2(g)+SO2(g)$\stackrel{\;}{?}$SO3(g)+NO(g)△H=-41.8KJ/mol;
故答案为:-41.8;
(2)负极发生氧化反应,氨气被氧化生成氮气,电极方程式为2NH3-6e-+3O2-=N2+3H2O,反应的总方程式为6NO2+8NH3$?_{加热}^{催化剂}$ 7N2+12H2O,反应中N元素化合价分别由+4价、-3价变化为0价,有1.2mol电子通过,由方程式可知生成0.35mol氮气,体积为0.35mol×22.4L/mol=7.84L,
故答案为:2NH3-6e-+3O2-=N2+3H2O;7.84;
(3)a.无论是否达到平衡,体系压强都保持不变,不能用于判断是否达到平衡状态,故a错误;
b.混合气体颜色保持不变,说明浓度不变,达到平衡状态,故b正确;
c.SO3和NO的计量数之比为1:1,无论是否达到平衡,二者的体积比保持不变,不能判断是否达到平衡状态,故c错误;
d.物质的量之比等于化学计量数之比,则每消耗1mol SO3的同时生成1molNO2,不能判断是否达到平衡状态,故d错误.
故答案为:b;
(4)5min后反应平衡,此时测得CH3OH的浓度为0.3mol/L,则v(CH3OH)=$\frac{0.3mol/L}{5min}$=0.06mol/(L•min),由方程式可知v(H2)=2v(CH3OH)=0.12mol/(L•min),
起始时容积为2L的密闭容器中充入2molCO和2molH2,即c(CO)=1mol/L、c(H2)=1mol/L,则
平衡时c(CH3OH)=0.3mol/L,则c(CO)=1mol/L-0.3mool/L=0.7mol/L,c(H2)=1mol/L-2×0.3mol/L=0.4mol/L,
k=$\frac{0.3}{0.7×0.{4}^{2}}$=2.68,
故答案为:0.12mol/(L•min); 2.68;
(5)从横坐标上一点0.5处,画一条平行于纵坐标的虚线,看相同压强下不同温度时CO的平衡转化率,温度越高转化率越低,说明,升温时平衡向逆向移动.
第二问:实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是工业生产要考虑速经济效益,要考虑速度和效率,压强越大需要的条件越高,花费越大.
故答案为:<;在1.3×104kPa下,CO的转化率已较高,再增大压强CO的转化率提高不大,而生产成本增加.
点评 本题以NO2、SO2、CO等物质为载体,综合考查化学平衡移动、盖斯定律计算等问题,为高频考点和常见题型,侧重于学生综合运用化学知识的能力的考查,题目难度中等.


 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:解答题
 ;B与溴水反应生成的物质名称为1,2-二溴乙烷;
;B与溴水反应生成的物质名称为1,2-二溴乙烷;
 .
.| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度(mol•L-1) | 0.44 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
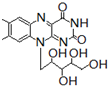
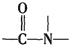 +H2O$→_{△}^{H+}$
+H2O$→_{△}^{H+}$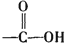 +
+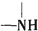 ,有关核黄素的下列说法中,正确的是( )
,有关核黄素的下列说法中,正确的是( )| A. | 该物质属于有机高分子 | B. | 不能发生酯化反应 | ||
| C. | 不能与氢气发生加成反应 | D. | 酸性条件下加热水解,有CO2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 门捷列夫利用软锰矿和浓盐酸反应制得了氯气 | |
| B. | 利用火力发电厂及核电站用于冷却的循环海水来提取单质溴以减少能耗 | |
| C. | 含重金属离子的污水的排放产生“赤潮”或“水华”等水污染现象 | |
| D. | 钢化玻璃、有机玻璃、防弹玻璃均属于硅酸盐材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.根据掌握的信息分析,装箱区的危险化学品可能有钾、钠、氯酸钠、硝酸钾、烧碱,硫化碱、硅化钙、三氯乙烯、氯碘酸等.运抵区的危险化学品可能有环己胺、二甲基二硫、甲酸、硝酸铵、氰化钠、4,6-二硝基苯-邻仲丁基苯酚等.
2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.根据掌握的信息分析,装箱区的危险化学品可能有钾、钠、氯酸钠、硝酸钾、烧碱,硫化碱、硅化钙、三氯乙烯、氯碘酸等.运抵区的危险化学品可能有环己胺、二甲基二硫、甲酸、硝酸铵、氰化钠、4,6-二硝基苯-邻仲丁基苯酚等.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
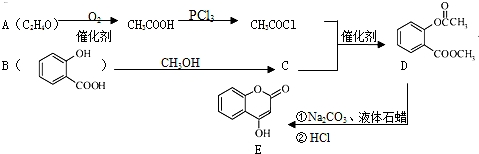
 .
. .
.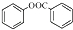 )是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).合成路线流程图示例如下:
)是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
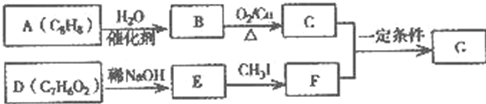

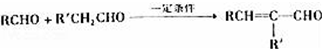
 .
. .
.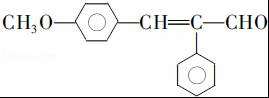 .
.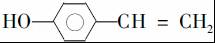 (写结构简式).
(写结构简式).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com