
【题目】某原电池结构如图所示,下列有关该原电池的说法不正确的是

A. 能将化学能转换成电能
B. 电子从铁棒经外电路流向碳棒,再经稀硫酸流向铁棒,形成闭合回路
C. 碳棒上发生还原反应
D. 总反应为Fe+H2SO4= FeSO4+H2↑
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ、用纯净的碳酸钙粉末跟稀盐酸反应制取二氧化碳气体,请回答下列问题:
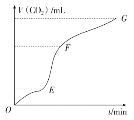
(1)实验过程如图所示,分析判断:________段化学反应速率最快。由该段图象说明:此反应属于________(填“吸热”或“放热”)反应。
(2)为了减缓上述反应的化学反应速率,欲向溶液中加入下列物质,你认为可行的是___(填字母)。
A.蒸馏水 B.NaCl固体 C.NaCl溶液 D.浓盐酸
(3)要减缓化学反应速率,除了上述方法外,你认为还可以采取的措施是_________。
Ⅱ、下图是温度和压强对反应X+Y![]() 2Z影响的示意图。图中纵坐标表示平衡混合气体中Z的体积分数。
2Z影响的示意图。图中纵坐标表示平衡混合气体中Z的体积分数。
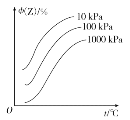
(1)若Z和X为气体,则Y为____体(填气或非气)。
(2)升高温度,v正____,v逆____(填增大或减小)。
(3)此平衡的平衡常数计算公式为:____________,温度升高,K____(填增大或减小)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是有关各种形式能量的相互转化途径的叙述,其中错误的是( )
A.家庭液化气灶将化学能转变为热能
B.灯泡将电能全部转变为光能
C.光合作用将光能转变为化学能
D.太阳能电池将光能转变为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是原子序数依次增大的同一短同期元素,A、B是金属元素,C、D是非金属元素。
(1)A、B各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为_____________________________________。
(2)A与C 可形成化合物A2C,该化合物的电子式为_______________________。
(3)C的低价氧化物通入D单质的水溶液中,发生反应的化学方程式为________________________________________。
(4)A、B、C、D四种元素简单离子的离子半径由大到小的顺序是(用离子符号表示):_____>_____>______>______。
(5)四种元素中金属性最强的(填元素符号)______;非金属性最强的__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组电极材料和电解质溶液中,不能组成原电池的是( )
A.铜片、石墨棒、稀硫酸
B.铜片、石墨棒、硝酸银溶液
C.锌片、铜片、稀盐酸
D.铜片、铁片、氯化铁溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 0.5mol![]() 含中子数为8NA
含中子数为8NA
B. 常温下,1 mol NH4Cl含共价键数目为5NA
C. 足量的Cu与含溶质1mol的浓H2SO4反应,转移的电子数为NA
D. 11.2LH2和O2的混合气体中分子数目为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵固体置于特制的密优真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡NH2COONH4(s) ![]() 2NH3(g)+CO2(g),若保持温度和容器体积不变,再充入n (NH3): n (CO)=2:1,则再次达到平衡时c (NH3)
2NH3(g)+CO2(g),若保持温度和容器体积不变,再充入n (NH3): n (CO)=2:1,则再次达到平衡时c (NH3)
A. 增大 B. 不变 C. 变小 D. 因条件不足无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的工业用途不正确的是
A. 铝单质:制导线,用作冶炼锰、钨的原料
B. 钠单质:制备过氧化钠、氯化钠等
C. 碳酸氢钠:制发酵粉、治疗胃酸过多
D. 碳酸钠:制玻璃、制肥皂、制烧碱、造纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
实验编号 | 实验温度 | 试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | |||
① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
③ | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
(1)请完成此实验设计,其中:V1= ,V2= 。
(2)实验①、②探究的是 对化学反应速率的影响,根据上表中的实验数据,可以得到的结论是_________________________________________________________。
(3)探究温度对化学反应速率的影响,应选择________________(填实验编号)。
(4)利用实验1中的数据,计算用KMnO4表示的化学反应速率为____________________。
(5)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示。

该小组同学根据图2所示信息提出了新的假设,并设计以下实验方案继续进行实验探究。
实验编号 | 实验温度/℃ | 试管中所加试剂及其用量 | 再向试管中加入某种固体 | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | ||||
④ | 25 | 2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t |
①该小组同学提出的假设是________________________________________________。
②若该小组同学提出的假设成立,应观察到________________________________现象。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com