
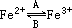 在A过程中,Fe2+做______剂,在B过程中,Fe3+体现______性;“如果服用维生素C,可使食物中三价铁离子转化成二价铁离子.“这句话指出,维生素C在这一反应中做______剂,具有______性.
在A过程中,Fe2+做______剂,在B过程中,Fe3+体现______性;“如果服用维生素C,可使食物中三价铁离子转化成二价铁离子.“这句话指出,维生素C在这一反应中做______剂,具有______性.

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 在A过程中,Fe2+做
在A过程中,Fe2+做查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
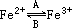 在A过程中,Fe2+做______剂,在B过程中,Fe3+体现______性;“如果服用维生素C,可使食物中三价铁离子转化成二价铁离子.“这句话指出,维生素C在这一反应中做______剂,具有______性.
在A过程中,Fe2+做______剂,在B过程中,Fe3+体现______性;“如果服用维生素C,可使食物中三价铁离子转化成二价铁离子.“这句话指出,维生素C在这一反应中做______剂,具有______性.查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com