
分析 (1)2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g) K1△H<0 (I)
2NO(g)+Cl2(g)?2ClNO(g) K2△H<0 (II)
根据盖斯定律,Ⅰ×2-Ⅱ可得:4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g),则该反应平衡常数为Ⅰ的平衡常数平方与Ⅱ的平衡常数的商;
(2)测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则△n(ClNO)=7.5×10-3mol•L-1•min-1×10min×2L=0.15mol,由方程式计算参加反应NO、氯气的物质的量,进而计算平衡时氯气的物质的量、NO的转化率;
正反应为气体物质的量减小的反应,恒温恒容下条件下,到达平衡时压强比起始压强小,其他条件保持不变,反应(Ⅱ)在恒压条件下进行,等效为在恒温恒容下的平衡基础上增大压强,平衡正向移动;
平衡常数只受温度影响,温度不变,平衡常数不变,正反应为放热反应,升高低温度平衡逆向向移动,平衡常数减小;
(3)0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,由2NO2+2NaOH═NaNO3+NaNO2+H2O,得到溶液A中NaNO3物质的量浓度为0.mol/L,NaNO2物质的量为0.1mol/L;
HNO2的电离常数Ka=7.1×10-4mol•L-1,CH3COOH的电离常数Ka=1.7×10-5mol•L-1,说明CH3COOH酸性小于HNO2的酸性,溶液中醋酸根离子水解程度小于亚硝酸根离子水解程度,溶液B碱性大于A溶液.
解答 解:(1)2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g) K1△H<0 (I)
2NO(g)+Cl2(g)?2ClNO(g) K2△H<0 (II)
根据盖斯定律,Ⅰ×2-Ⅱ可得:4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g),则该反应平衡常数K=$\frac{{{K}_{1}}^{2}}{{K}_{2}}$,
故答案为:$\frac{{{K}_{1}}^{2}}{{K}_{2}}$;
(2)测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则△n(ClNO)=7.5×10-3mol•L-1•min-1×10min×2L=0.15mol,
由方程式可知,参加反应氯气的物质的量为0.15mol×$\frac{1}{2}$=0.075mol,故平衡时氯气的物质的量为0.1mol-0.075mol=0.025mol;
参加反应NO物质的量为0.15mol,则NO的转化率为$\frac{0.15mol}{0.2mol}$×100%=75%;
正反应为气体物质的量减小的反应,恒温恒容下条件下,到达平衡时压强比起始压强小,其他条件保持不变,反应(Ⅱ)在恒压条件下进行,等效为在恒温恒容下的平衡基础上增大压强,平衡正向移动,NO转化率增大,故转化率α2>α1,
平衡常数只受温度影响,温度不变,平衡常数不变,正反应为放热反应,升高温度平衡逆向移动,平衡常数减小,
故答案为:0.025;75%;>;不变;升高温度;
(3)0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,由2NO2+2NaOH═NaNO3+NaNO2+H2O,得到溶液A中NaNO3物质的量浓度为0.mol/L,NaNO2物质的量为0.1mol/L,溶液B为0.1mol•L-1的CH3COONa溶液;
HNO2的电离常数Ka=7.1×10-4mol•L-1,CH3COOH的电离常数Ka=1.7×10-5mol•L-1,说明CH3COOH酸性小于HNO2的酸性,溶液中醋酸根离子水解程度小于亚硝酸根离子水解程度,溶液B碱性大于A溶液,两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为c(NO3-)>c(NO2-)>c(CH3COO-),
a.溶液B碱性大于A溶液,向溶液A中加适量水,稀释溶液,碱性减弱,不能调节溶液pH相等,故a错误;
b.向溶液A中加适量NaOH,增大碱性,可以调节溶液pH相等,故b正确;
c.向溶液B中加适量水,稀释溶液碱性减弱,可以调节溶液pH相等,故c正确;
d.溶液B碱性大于A溶液,向溶液B中加适量NaOH,溶液pH更大,故d错误;
故答案为:c(NO3-)>c(NO2-)>c(CH3COO-);bc.
点评 本题考查化学平衡计算与影响因素、化学平衡常数、盐类水解、离子浓度大小比较等知识,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用基础知识的能力,需要学生具备扎实的基础与灵活应用能力,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 胶体粒子大小介于1纳米致100纳米之间,所以纳米材料全部属于胶体 | |
| B. | CO2的水溶液能导电,所以CO2为电解质 | |
| C. | 可使用丁达尔效应来区分FeCl3溶液和Fe(OH)3胶体 | |
| D. | 1 mol 任何物质均含有约6.02×1023个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
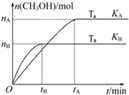 一定条件下,在容积为3L的密闭容器中加入1molCO和2molH2发生反应:CO(g)+2H2(g)?CH3OH(g)△H,达平衡状态.根据图示回答:
一定条件下,在容积为3L的密闭容器中加入1molCO和2molH2发生反应:CO(g)+2H2(g)?CH3OH(g)△H,达平衡状态.根据图示回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/10-4mol.L-1 | 10.0 | 4.05 | 2.50 | 1.60 | 1.00 | 1.00 |
| c(CO)/10-3mol.L-1 | 3.60 | 3.05 | 2.85 | 2.76 | 2.70 | 2.70 |
| A. | 该反应的平衡常数和转化反应速率在夏季时比冬季时高 | |
| B. | 2~3s间的平均反应速率v(NO)=0.9 moI/(L•s) | |
| C. | 该温度下,此反应的平衡常数K=500 | |
| D. | 若该催化转化器气舱容积为2L,则达到平衡时反应放出热量0.9aJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 373K时,某 2L密闭容器中加入2mol NH3发生如下可逆反应:2NH3(g)?N2(g)+3H2(g).其中物质H2的物质的量变化如图所示.
373K时,某 2L密闭容器中加入2mol NH3发生如下可逆反应:2NH3(g)?N2(g)+3H2(g).其中物质H2的物质的量变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 金属离子 | 开始沉淀 | 沉淀完全 |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+ | 4.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 氧化还原反应与放热反应属于包含关系 | |
| B. | 溶液与胶体属于并列关系 | |
| C. | 化合物与碱性氧化物属于交叉关系 | |
| D. | 化合物与电解质属于重叠关系 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com