
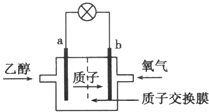
 在2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇(CH3OH)电池效率高出32倍,且更安全.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意图如图所示,下列说法中正确的是( )
在2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇(CH3OH)电池效率高出32倍,且更安全.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意图如图所示,下列说法中正确的是( )| A. | a极为电池的正极 | |
| B. | 电池工作时电子由b极沿导线经灯泡再到a极 | |
| C. | 电池正极的电极反应为:4H++O2+4e-=2H2O | |
| D. | 电池工作时,1 mol乙醇被氧化时就有6 mol电子转移 |
分析 该燃料电池中,通入燃料乙醇的电极是负极,则a是负极,通入氧化剂氧气的电极b是正极,电解质溶液呈酸性,则负极反应式为C2H5OH+3H2O-12e-=2CO2+12H+,正极氧气得到电子被还原,电极反应式为4H++O2+4e-=2H2O,据此分析解答.
解答 解:A.燃料电池中通入氧化剂的电极是正极,通入燃料的电极是负极,则a极为原电池负极、b极是正极,故A错误;
B.放电时,电子从负极沿导线流向正极,a是负极、b是正极,则电池工作时电子由a极沿导线经灯泡再到b极,故B错误;
C.放电时,正极上氧气得电子发生还原反应,电极反应式为:4H++O2+4e-=2H2O,故C正确;
D.电池工作时,根据C2H5OH+3H2O-12e-=2CO2+12H+知,1 mol乙醇被氧化时就有12 mol电子转移,故D错误;
故选C.
点评 本题考查化学电源新型电池,为高考高频点,所有燃料电池中负极上都是燃料失电子发生氧化反应,会正确书写电极反应式,要结合电解质溶液酸碱性书写,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 在酒精灯上加热铝箔 | 铝箔熔化但不滴落 | 熔点:铝>氧化铝 |
| B | 某酸雨试样中加入Ba(OH)2溶液 | 产生白色沉淀 | 酸雨试样中只含SO42- |
| C | 用玻璃棒蘸取浓硫酸点到蓝色石蕊试纸上 | 试纸变黑 | 浓硫酸具有脱水性 |
| D | 食用加碘盐加入食醋和KI溶液,再加入CCl4振荡,静置 | 下层呈紫红色 | 该食用加碘盐含有KIO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
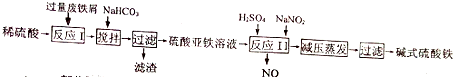
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
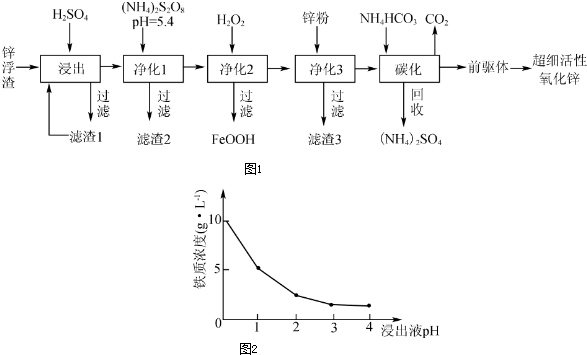
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 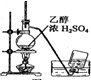 制备乙烯 | B. | 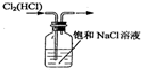 除去Cl2中的HCl | ||
| C. | 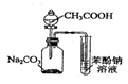 证明酸性:CH3COOH>H2CO3>苯酚 | D. | 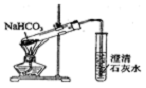 探究NaHCO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水冷却到0℃以下时变成冰,是因为水分子从液体变成了固体 | |
| B. | 所有物质在温度变化时都能表现出三态变化 | |
| C. | 不降低温度,只增大压强,也可能使物质从气态变成固态 | |
| D. | 物质能热胀冷缩是因为构成物质的微粒能够热胀冷缩 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
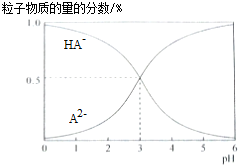
| A. | H2A的电离方程式为:H2A?H++HA- | |
| B. | pH=5时,在NaHA和Na2A的混合溶液中:c(HA-):c(A2-)=1:100 | |
| C. | 等物质的量浓度的NaHA和Na2A溶液等体积混合,离子浓度大小关系为c(Na+)>c(HA-)>c(A2-) | |
| D. | Na2A溶液必存在c(OH-)=c(H+)+c(HA-)+2c(H2A),各粒子浓度均大于0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com