
分析 (1)硫酸铵为强酸弱碱盐,铵根离子水解导致溶液呈酸性,再结合电荷守恒判断离子浓度大小;
(2)碳酸氢钠溶液中存在碳酸氢根离子的水解、电离平衡;
(3)亚铁离子和铵根水解均显酸性,亚铁离子水解抑制铵根的水解,(NH4)2Fe(SO4)2溶液中c(NH4+)稍大,以此解答该题;
(4)根据Ksp=c(Ag+)×c(Cl-)计算.
解答 解:(1)硫酸铵为强酸弱碱盐,铵根离子水解导致溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒得c (NH4+)>c(SO42-),铵根离子水解程度较小,则溶液中离子浓度大小顺序是c(NH4+)>c(SO42-)>c(H+)>c(OH-),
故答案为:c(NH4+)>c(SO42-)>c(H+)>c(OH-);
(2)碳酸氢钠溶液中存在碳酸氢根离子的水解、电离平衡,其离子方程式分别为:HCO3-?H++CO32-、HCO3-+H2O?H2CO3+OH-,
故答案为:HCO3-?H++CO32-、HCO3-+H2O?H2CO3+OH-;
(3)(NH4)2Fe(SO4)2中NH4+和Fe2+都水解呈酸性,水解相互抑制,因此(NH4)2Fe(SO4)2中NH4+的水解程度(NH4)2SO4的要小,(NH4)2Fe(SO4)2比(NH4)2SO4的c(NH4+)大.
故答案为:(NH4)2Fe(SO4)2;NH4+和Fe2+都水解呈酸性,水解相互抑制;
(4)现将足量AgCl放入100mL 0.3mol/LAgNO3溶液中,充分搅拌后冷却到原温度,此时溶液 中Cl-物质的量浓度为c(Cl-)=$\frac{1.8×1{0}^{-10}}{0.3}$mol/L=6×10-10 mol/L,
故答案为:6×10-10 mol/L.
点评 本题考查了离子浓度大小比较、难溶物的溶解平衡等知识点,根据溶质的性质结合电荷守恒判断离子浓度大小,根据溶度积常数计算氯离子浓度,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. |  | B. | HC≡C-CH2-CH3 | C. | CH2=C(CH3)2 | D. | CH2=CHCH=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向久置的氯水中滴入紫色石蕊试液,溶液将先变红后褪色 | |
| B. | 欲除去Cl2中少量HCl气体,可将此混合气体通过盛饱和食盐水的洗气瓶 | |
| C. | 漂白粉的有效成分是CaCl2和Ca(ClO)2,应密闭保存 | |
| D. | 氯气有漂白性,所以氯气能使有色布条褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往NaHSO4溶液中滴加Ba(OH)2至溶液中性:SO42-+2H++Ba2++2OH-═BaSO4↓+2H2O | |
| B. | SO2通入酸性KMnO4溶液,褪色:2MnO4-+4H++5SO2═2Mn2++5SO42-+2H2O | |
| C. | 次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2═CaCO3?+2HClO | |
| D. | 等物质的量MgCl2、Ba(OH)2和HCl溶液混合:Mg2++3OH-+H+═Mg(OH)2↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
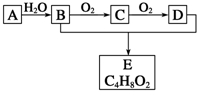 有机化合物A只由C、H两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化学工业的发展水平.A、B、C、D、E有如图所示的关系.则下列推断正确的是( )
有机化合物A只由C、H两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化学工业的发展水平.A、B、C、D、E有如图所示的关系.则下列推断正确的是( )| A. | 鉴别A和甲烷可选择酸性高锰酸钾溶液 | |
| B. | B能与金属钠反应D不能 | |
| C. | 物质C和氢气反应生成乙醇,是还原反应 | |
| D. | E没有同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g | B. | 56g | C. | 14g | D. | 无法计算 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com