
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加入盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入碳酸钠溶液产生白色沉淀,再加入盐酸白色沉淀消失,一定有Ba2+ | |
| D. | 某溶液中加入氢氧化钠溶液生成蓝色沉淀,一定有Cu2+ |
分析 A.该气体可能为二氧化碳、二氧化硫,原溶液中可能含有碳酸氢根离子、亚硫酸根离子等,不一定含有碳酸根离子;
B.加入氯化钡溶液生成的不溶于盐酸的白色沉淀可能为氯化银,原溶液中可能含有银离子;
C.能够与碳酸钠生成的溶于盐酸的白色沉淀不一定为碳酸钡,可能为碳酸钙,原溶液中可能含有钙离子;
D.加入氢氧化钠后生成的蓝色沉淀为氢氧化铜,则溶液中一定含有铜离子.
解答 解:A.将气体通入澄清石灰水中,溶液变浑浊,生成的气体可能为二氧化硫、二氧化碳,原溶液中可能存在HCO3-、SO32-等离子,不一定含有CO32-,故A错误;
B.氯化钡能与硫酸根离子或银离子结合生成不溶于水也不溶于酸的沉淀,加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,原溶液中可能含有银离子,不一定含有SO42-,故B错误;
C.碳酸钡和碳酸钙等沉淀都可溶于盐酸,原溶液中可能含有Ca2+,不一定含有Ba2+,故C错误;
D.溶液中加入氢氧化钠溶液生成蓝色沉淀,该蓝色沉淀为氢氧化铜,溶液中一定有Cu2+,故D正确;
故选D.
点评 本题考查了常见离子的性质及检验方法,题目难度中等,试题侧重于物质的检验和鉴别的考查,解答该类题目要注意排除离子的干扰的现象,注意实验的严密性.


科目:高中化学 来源: 题型:解答题
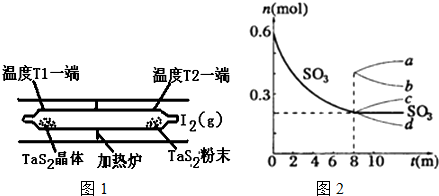
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ已知化学反应①:Fe(s)+CO2(g)?FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)?FeO(s)+H2(g),其平衡常数为K2.在温度973K和1173K情况下,K1、K2的值分别如表:
Ⅰ已知化学反应①:Fe(s)+CO2(g)?FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)?FeO(s)+H2(g),其平衡常数为K2.在温度973K和1173K情况下,K1、K2的值分别如表:| 温度 | K1 | K2 |
| 973K | 1.47 | 2.33 |
| 1173K | 2.15 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①③④ | C. | ②③⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 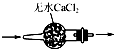 干燥SO2气体 | |
| B. | 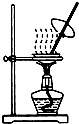 蒸发CH3COONa溶液得醋酸钠晶体 | |
| C. | 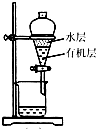 分离有机层与水层,水层从分液漏斗下口放出 | |
| D. | 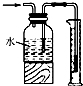 测量氯气的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
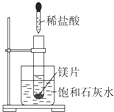 如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入一小块镁片,再用滴管滴入10mL 0.2mol/L的稀盐酸于试管中,测得生成氢气在标况的体积为11.2mL后反应停止,同时观察到盛饱和石灰水的烧杯中出现浑浊的现象.请回答下列问题:
如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入一小块镁片,再用滴管滴入10mL 0.2mol/L的稀盐酸于试管中,测得生成氢气在标况的体积为11.2mL后反应停止,同时观察到盛饱和石灰水的烧杯中出现浑浊的现象.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下22.4L的CO2在一定条件下与足量的镁反应,转移4NA个电子 | |
| B. | 60g SiO2中含硅氧键数目为4NA | |
| C. | 1.00mol NaCl中含有6.02×1023个NaCl分子 | |
| D. | 3.9gNa2O2中所含的阴离子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com