
| A. | pH:②>③>④>① | B. | c(CH3COO-):②>④>③>① | ||
| C. | 溶液中c(Na+):①>③>②>④ | D. | c(CH3COOH):①>④>③>② |
分析 根据溶液的溶质来分析酸碱性,一般酸与盐的溶液显酸性,碱与盐的溶液显碱性,则①中显酸性,②中显碱性,③中只有CH3COONa水解显碱性,④中两种物质都水解显碱性;溶液酸性越强,溶液pH越小,碱性越强,溶液的pH越大,然后根据盐的水解程度、溶液的酸碱性对选项进行分析解答.
解答 解:A、①CH3COONa与HCl等浓度混合生成醋酸和氯化钠,溶液的pH<7,②中有强碱氢氧化钠,溶液pH最大,③④都因盐的水解而显碱性,且④中NaHCO3的水解也水解成碱性,所以溶液的pH④>③,所以各混合液中的pH大小为:②>④>③>①,故A错误;
B.因②中碱中的OH-抑制CH3COO-水解,则c(CH3C00-)最大,④中两种盐相互抑制水解,③中只有水解,而①中CH3COO-与酸结合生成弱电解质,则c(CH3C00-)最小,即c(CH3C00-)的大小顺序为:②>④>③>①,故B正确;
C.由于4种混合溶液,分别由等体积0.1mol/L的2种溶液混合而成,而钠离子在溶液中的量不变,故可知四种混合溶液中钠离子的物质的量的关系为①<②=③=④,则混合后溶液中的c(Na+):①<②=③=④,故C错误;
D、因水解程度越大,则生成的CH3COOH就多,则c(CH3COOH)③>④>②,而①中CH3COO-与酸结合生成弱电解质CH3COOH,则c(CH3COOH)最大,即c(CH3COOH)①>③>④>②,故D错误;
故选B.
点评 本题考查溶液中粒子浓度大小比较、盐的水解原理及其应用,题目难度中等,试题较好的训练学生的守恒思想和综合分析能力,明确混合溶液中酸碱性分析的规律及盐类水解、水解的相互影响等因素是解答的关键.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 mol甲基(-CH3)中所含电子数为10NA | |
| B. | 2.8 g乙烯与丙烯的混合物中含碳原子的数目为0.2NA | |
| C. | CH3-CH═CH-C≡C-CF3分子结构中6个碳原子可能都在一条直线上 | |
| D. | 制取1,2二溴乙烷的最合理的方法是乙烯与HBr进行加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO、浓硫酸、HNO3均具有氧化性,都是氧化性酸 | |
| B. | H2O、Na2O2、HClO均含有氧元素,都是氧化物 | |
| C. | HF、NH3、CH3CH2OH都易溶于水,都是电解质 | |
| D. | 碱性氧化物都是金属氧化物,因此金属氧化物都是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器中各组分的物质的量不随时间变化 | |
| B. | 容器内三种气体 AB、A2、B2共存 | |
| C. | 2v正(AB)=v逆(A2) | |
| D. | 单位时间内消耗n mol A2,同时生成2n mol AB |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
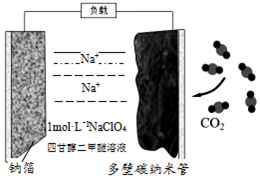 最近我国科学家发明“可充电钠-二氧化碳电池”(如图),放电时电池总反应为:a+3CO2=2Na2CO3+C.下列说法错误的是( )
最近我国科学家发明“可充电钠-二氧化碳电池”(如图),放电时电池总反应为:a+3CO2=2Na2CO3+C.下列说法错误的是( )| A. | 充电时,钠箔与外接电源的负极相连 | |
| B. | 电池工作温度可能在200℃以上 | |
| C. | 放电时,Na+向正极移动 | |
| D. | 放电时,正极的电极反应为:4Na++3CO2+4e-=2Na2CO3+C |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 | |
| B. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- | |
| C. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ | |
| D. | 向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com